
| A. | 由H2、I2(g)、HI组成的平衡体系,加压后颜色加深 | |
| B. | 用加热蒸干AlCl3溶液的方法不能制得无水AlCl3 | |
| C. | 蒸馏水和0.1mol•L-1 NaOH溶液中的c(H+),前者大于后者 | |
| D. | 向含有少量Fe3+的MgCl2酸性溶液中加MgCO3,可将Fe3+转化成Fe(OH)3除去 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A、该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故A选;
B、加热氯化铝溶液时,氯化铝水解生成氢氧化铝和盐酸,升高温度促进盐酸挥发,从而促进氯化铝水解,蒸干溶液得到氢氧化铝而不是氯化铝,可以用平衡移动原理解释,故B不选;
C、水的电离是可逆反应,向水中加入NaOH溶液时,溶液中氢氧根离子浓度增大,抑制水的电离,所以蒸馏水和0.1 mol•L-1NaOH溶液中的c(H+),前者大于后者,能用平衡移动原理解释,故C不选;
D、加入MgCO3 与酸及铁离子水解生成的氢离子反应,会促进水解反应的正向进行,铁离子转化为氢氧化铁沉淀,使铁离子沉淀完全,与平衡移动原理有关,故D不选.
故选A.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.


科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaHCO3固体都能受热发生分解 | |
| B. | H2、SO2、CO2三种气体都可用浓硫酸干燥 | |
| C. | Fe(OH)3胶体无色、透明,能产生丁达尔现象 | |
| D. | SiO2既能和氢氧化钠溶液反应有能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅥⅠA | 0 |
| 2 | C | O | F | |||||
| 3 | Na | Mg | P | S | Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖、蔗糖均能水解 | |
| B. | 福尔马林、水玻璃、一水合氨均为混合物 | |
| C. | 反应:NH4Cl (s)═NH3(g)+HCl(g)在室温下不能自发进行,说明该反应的△H>0 | |
| D. | C(石墨,s)═C (金刚石,s)△H=+1.9kJ•mol-1,说明金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Fe3+、NO3-、SCN- | B. | Al3+、Fe2+、Cl-、SO42- | ||
| C. | K+、Na+、Cl-、HCO3- | D. | Na+、CH3COO-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的氧化物可用作于耐高温材料 | B. | Na2O2可用作漂白剂 | ||
| C. | 碱石灰可用于干燥CO2、O2等气体 | D. | 小苏打可用于治疗胃酸过多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室常用地康法制氯气 | B. | 氧化性强弱顺序是O2>KMnO4>MnO2 | ||
| C. | 氧化性强弱顺序是KMnO4>O2>MnO2 | D. | 氧化性强弱顺序是KMnO4>MnO2>O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2燃烧热为285.8 kJ•mol-1,则2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| B. | 若C(石墨,s)=C(金刚石,s)△H>0,则石墨比金刚石稳定 | |
| C. | 已知NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l)△H=-57.4 kJ•mol-1,则0.5mol NaOH固体与稀盐酸完全中和,放出28.7kJ的热量 | |
| D. | 已知2SO2(g)+O2(g)?2SO2 (g)△H=-196.64 kJ•mol-1,在一定温度下,向一固定体积的密闭容器中通入2mol SO2、1mol O2,达到平衡时放出热量小于196.64 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
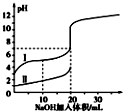 室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )
室温下,用 0.100mol/L NaOH 溶液分别与 20.00mL 0.100mol/L 的盐酸和醋酸反应,pH 与滴入碱的体积关系如图所示. 已知醋酸电离常数 K=1.7×10 -5下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的反应曲线 | |
| B. | pH=7 时,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=170 | |
| C. | V(NaOH)=10.00 mL 时,醋酸溶液的导电性更强 | |
| D. | 向盐酸中加 NaOH 至 pH=12 时,V(NaOH)=200/9 mL |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com