
·ÖĪö ¢Łøł¾Żn=$\frac{m}{M}$¼ĘĖć³öĮņĖįĶ¾§ĢåµÄĪļÖŹµÄĮ棬ŌŁøł¾Żc=$\frac{n}{V}$¼ĘĖć³öČÜŅŗÅØ¶Č£»
¢ŚÉč³öČÜŅŗĢå»ż£¬øł¾Żc=$\frac{n}{V}$¼ĘĖć³ö»ģŗĻŅŗÖŠĮņĖįøłĄė×ÓµÄÅØ¶Č£»
¢Ūøł¾Ż·“Ó¦·½³ĢŹ½¼ĘĖć³ö·“Ó¦ŗóČÜŅŗÖŠŃĒĢśĄė×ÓµÄÅØ¶Č£®
½ā“š ½ā£ŗ¢Ł50gCuSO4•5H2O µÄĪļÖŹµÄĮæĪŖ£ŗ$\frac{50g}{250g/mol}$=0.2mol£¬ĖłµĆČÜŅŗµÄÅضČĪŖ£ŗ$\frac{0.2mol}{0.1L}$=2mol•L-1£¬
¹Ź“š°øĪŖ£ŗ2mol•L-1 £»
¢ŚÉčČÜŅŗĢå»żĪŖVL£¬Ōņ»ģŗĻŅŗÖŠĮņĖįøłĄė×ÓÅضČĪŖ£ŗc=$\frac{2mol/L”ĮVL+1mol/L”ĮVL}{2VL}$=1.5mol/L£¬
¹Ź“š°øĪŖ£ŗ1.5mol/L£»
¢Ū·¢Éś·“Ó¦ĪŖ£ŗFe+CuSO4=FeSO4+Cu£¬øł¾Ż·“Ó¦·½³ĢŹ½æÉÖŖ£¬ĢśĄė×ÓÅضČÓėĶĄė×ÓµÄÅضČĻąµČ£¬¼“£ŗc£ØFe2+£©=c£ØCu2+£©=2mol/L£¬
¹Ź“š°øĪŖ£ŗ2mol/L£®
µćĘĄ ±¾Ģāæ¼²éĮĖĪļÖŹµÄĮæÅØ¶ČµÄ¼ĘĖć”¢»Æѧ·½³ĢŹ½µÄ¼ĘĖć£¬ĢāÄæÄѶČÖŠµČ£¬Ć÷Č·ĪļÖŹµÄĮæÅØ¶ČµÄ±ķ“ļŹ½ĪŖ½ā“š¹Ų¼ü£¬×¢ŅāÕĘĪÕĪļÖŹµÄĮæÓėĦ¶ūÖŹĮ攢ĪļÖŹµÄĮæÅضČÖ®¼äµÄ¹ŲĻµ£®


 ¼¤»īĖ¼Ī¬ÓżÓæĪĢĆĻµĮŠ“š°ø
¼¤»īĖ¼Ī¬ÓżÓæĪĢĆĻµĮŠ“š°ø »īĮ¦ŹŌ¾ķĻµĮŠ“š°ø
»īĮ¦ŹŌ¾ķĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £®
£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | Ļ”¶¹½¬--½ŗĢå | B£® | Ģ¼ĖįÄĘ--ÕżŃĪ | ||
| C£® | Ķ--·Ēµē½āÖŹ | D£® | NaH+H2O=NaOH+H2”ü--Ńõ»Æ»¹Ō·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HCl  | B£® | HClO  | C£® | H2O2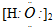 | D£® | Na2O2 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā

| A£® | 1molM×ī¶ąæÉŗĶ1molNa2CO3·¢Éś·“Ó¦ | |
| B£® | 1molM×ī¶ąæÉŗĶ6molH2·¢Éś¼Ó³É·“Ó¦ | |
| C£® | 1molM×ī¶ąæÉŗĶ3molNaOH·“Ó¦ | |
| D£® | 1molM×ī¶ąæÉŗĶ2molNa·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ÉÕ¼ī”¢ŅŗĢ¬Ńõ”¢±łĖ®»ģŗĻĪļ | B£® | ÉśŹÆ»Ņ”¢°×Į×”¢Š”ĖÕ“ņ | ||
| C£® | øɱł”¢Ģś”¢°±Ė® | D£® | æÕĘų”¢µŖĘų”¢µØ·Æ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com