
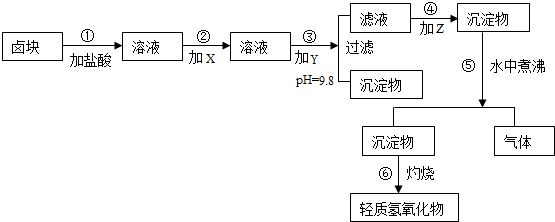
| 物质 | 开始沉淀 | 沉淀完全 | 试剂 | 价格(元/吨) | |
| Fe(OH)3 | 2.7 | 3.7 | 漂液(含NaClO25.2%) | 450 | |
| Fe(OH)2 | 7.6 | 9.6 | H2O2(30%) | 2400 | |
| Mn(OH)2 | 8.3 | 9.8 | NaOH(固98%) | 2100 | |
| Mg(OH)2 | 9.6 | 11.1 | Na2CO3(固95%) | 600 | |
| 卤块(MgCl2,30%) | 310 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾与水反应生成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 |
| B、当光束通过鸡蛋清水溶液时,能观察到丁达尔效应 |
| C、水泥厂用高压电作用于气溶胶以除去烟尘,是根据胶体带电这个性质而设计的 |
| D、Li是最轻的金属,也是活动性强的金属,是制造电池的理想物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 分子式 | 熔点 (℃) | 沸点 (℃) | 密度 (g/cm3) | 水中 溶解性 |
| 甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
| 乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:
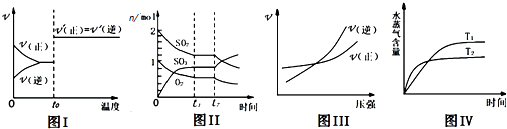
| A、图I:反应CO+NO2═CO2+NO达平衡后,升高温度时反应速率随时间的变化 |
| B、图Ⅱ:反应2SO2+O2═2SO3 达平衡后,缩小容器体积时各成分的物质的量随时间的变化 |
| C、图Ⅲ:反应N2+3H2═2NH3在恒温情况下,反应速率与压强的关系 |
| D、图Ⅳ:反应CO2(g)+H2(g)═CO(g)+H2O(g)△H>0,水蒸气含量随时间的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子晶体中一定存在分子间作用力,不一定存在共价键 |
| B、分子中含两个氢原子的酸一定是二元酸 |
| C、非极性分子中一定含有非极性键 |
| D、元素的非金属性越强,其单质的活泼性一定越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com