
【题目】(1)某反应中反应物与生成物有:FeSO4、Fe2(SO4)3、CuSO4、Cu。将上述反应设计成的原电池如图(1)所示,请回答下列问题:
①溶液X是____________溶液;
②Cu电极上发生的电极反应式为__________________________________________;

(2)一种熔融碳酸盐燃料电池原理示意如图(2)。
①电极A上CO参与的电极反应式为______________________________。
②电极B处除了通O2外,还需通入的物质A为__________。
③电池工作时,电池内部CO32-的物质的量__________(填“增大”、“减少”或“不变”)。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O![]() Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
Na2FeO4+3H2↑。高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为_______________________________________。
【答案】Fe2(SO4)3 Cu-2e-===Cu2+ CO-2e-+CO32-=2CO2 CO2 不变 2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O
【解析】
(1)①Fe2(SO4)3具有强氧化性,铜能被氧化为铜离子;
②Cu作负极,失电子发生氧化反应;
(2)①一氧化碳变为二氧化碳发生氧化反应;
②电极B为正极,发生还原反应:O2+4e-+2CO2=2CO32-,从极反应可知,需要不断补充CO2;
③根据该原电池的正负极极反应判断电池内部CO32-的物质的量变化情况;
(3)NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,据此写出离子反应方程式。
(1)①Fe2(SO4)3具有强氧化性,铜能被硫酸铁氧化,所以反应为Fe3++Cu=Fe2++Cu2+;则Fe2(SO4)3溶液为电解质溶液;
因此,本题正确答案是: Fe2(SO4)3。
②Cu作负极,失电子发生氧化反应,电极反应为Cu-2e-===Cu2+ ,因此,本题正确答案是: Cu-2e-===Cu2+ 。
(2)①根据图示可知,一氧化碳变为二氧化碳,碳元素化合价升高,发生氧化反应,电极A上CO参与的电极反应式为:CO-2e-+CO32-=2CO2 ;综上所述,本题答案是: CO-2e-+CO32-=2CO2。
②电极B为正极,发生还原反应:O2+4e-+2CO2=2CO32-,从极反应可知,需要不断补充CO2;
综上所述,本题答案是:CO2。
③该反应负极反应为:2CO-4e-+2CO32-=4CO2,正极反应为O2+4e-+2CO2=2CO32-,从以上两个极反应可知,电池工作时,电池内部CO32-的物质的量不变;
综上所述,本题答案是:不变。
(3)NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的方程式为: 2Fe(OH)3+3NaClO+4NaOH===2Na2FeO4+3NaCl+5H2O,离子方程式为2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O。
综上所述,本题答案是:2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】氯水中含有多种成分,因而具有多种性质,根据氯水分别与如图四种物质作用(四种物质与氯水的重合部分代表物质间的反应,且氯水足量),请回答下列问题:
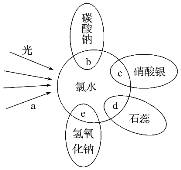
(1)能证明氯水具有漂白性的是___(填“a”“b”“c”“d”或“e”)。
(2)反应c过程中的现象是___,反应e的化学方程式为___,反应b的化学方程式为___。
(3)久置的氯水最终会变成___,用化学反应方程式表示为___。
(4)实验室保存氯水的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋氯芬酸(H)是一种新型、强效解热、镇痛、抗关节炎药物,其合成路线如下(部分反应条件省略):
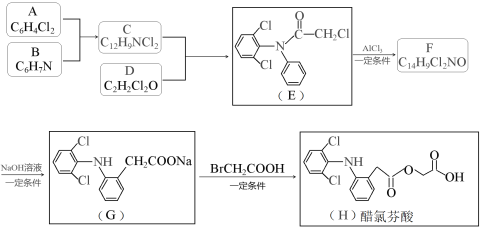
已知:

请回答:
(1)化合物F的结构简式是__________________;
(2)写出C+D→E的化学方程式____________________________________________;
(3)下列说法不正确的是__________。
A.化合物A中所有原子肯定处于同一平面
B.化合物B具有碱性
C.化合物E与NaOH溶液反应最多消耗4molNaOH
D.醋氯芬酸分子式为C16H12Cl2NO4
(4)已知C的同分异构体有多种,写出同时满足下列条件的所有同分异构体的结构简式_______。
①IR谱表明分子中含有两个苯环结构,且2个氯原子不在同一个苯环上;
②1H-NMR谱显示只有5种不同环境的氢原子
(5)设计以苯和乙烯为原料合成 ![]() 的路线(用流程图表示,无机试剂任选)。
的路线(用流程图表示,无机试剂任选)。
______________________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从元素化合价升降的角度分析,下列不属于氧化还原反应的是
A. H2+Cl2![]() 2HCl B. 2HClO
2HCl B. 2HClO![]() 2HCl+O2
2HCl+O2
C. 2NaI+Br2=2NaBr+I2 D. CaCl2+Na2CO3=CaCO3↓+2NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )
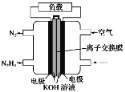
A. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
B. 电子从右侧电极经过负载后流向左侧电极
C. 负极发生的电极反应式为N2H4+4OH--4e-===N2+4H2O
D. 该燃料电池持续放电时,OH-从正极向负极迁移,因而离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图表示某可逆反应在使用和未使用催化剂时,反应过程和能量的对应关系。下列说法一定正确的是

A. 该反应为吸热反应
B. a与b相比,a的反应速率更快
C. a与b相比,反应的平衡常数一定不同
D. 反应物吸收的总能量小于生成物释放的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+I2(g)![]() 2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
2HI(g)△H=-14.9kJ·mol-1。某温度下,在体积均为2.0L的甲、乙两个恒容密闭容器中充入反应物,其起始物质的量如下表所示。甲中反应达到平衡时,测得c(H2)=0.008mol·L-1。下列判断正确的是( )
起始物质的量 | n(H2)/mol | n(I2)/mol | n(HI)/mol |
甲 | 0.02 | 0.02 | 0 |
乙 | 0.04 | 0.04 | 0 |
A. 平衡时,乙中H2的转化率是甲中的2倍
B. 平衡时,甲中混合物的颜色比乙中深
C. 平衡时,甲、乙中热量的变化值相等
D. 该温度下,反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是
A. 铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑
B. 一水合氨的电离:NH3·H2O=NH4++OH-
C. 食醋除去水垢中的碳酸钙:CaCO3+2H+=Ca2++CO2↑+H2O
D. 氯气与氢氧化钠溶液反应:Cl2+2OH- =Cl-+ClO-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解NaB(OH)4溶液制备H3BO3的原理如下图所示,下列叙述错误的是
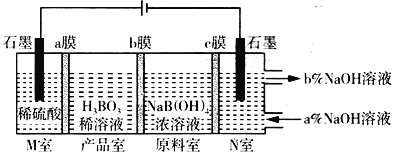
A. M室发生的电极反应式:2H2O-4e-=O2↑+4H+
B. a、c为阴离子交换膜,b为阳离子交换膜
C. N室中:a%<b%
D. 理论上每生成1 mol H3BO3,两极室共产生标准状况下16.8 L气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com