
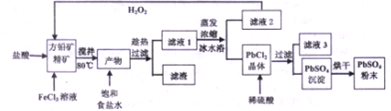
分析 往方铅矿精矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液1含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液1蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液2中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液3中含有HCl及硫酸.
(1)FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成;
由Fe3+、Pb2+以氢氧化物形式完全沉淀时溶液的pH,分析加入盐酸的主要目的;
(2)根据温度、浓度对平衡移动的影响进行分析;
(3)过氧化氢将滤液2中Fe2+氧化为Fe3+,在循环利用;
(4)PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅,反应还生成HCl;
(5)铅蓄电池充电时为电解池,放电是为原电池,正极发生还原反应,PbO2在正极获得电子,硫酸条件下反应生成PbSO4与水;
原电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,根据消耗的硫酸的量计算转移电子物质的量,电解饱和氯化钠溶液,电解池总反应为:2NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2+2NaOH,根据转移电子计算参加反应的NaCl的质量,氢气与氯气的质量等于溶液质量减少量,结合溶解度计算原溶液中NaCl的质量,再计算剩余溶液中NaCl的质量,进而计算质量分数.
解答 解:往方铅矿精矿中加入FeCl3溶液和盐酸,FeCl3与PbS反应生成PbCl2和S,产物中加入饱和食盐水,趁热过滤,利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解,过滤除去硫等杂质,滤液1含有PbCl4-、Cl-、Fe2+、Fe3+等,滤液1蒸发浓缩,冷水浴中冷却,利用平衡逆向进行,析出PbCl2晶体,滤液2中含有Fe2+、Fe3+,用过氧化氢进行氧化后循环利用,PbCl2晶体中加入稀硫酸,转化为更难溶的硫酸铅沉淀,过滤得到硫酸铅沉淀,洗涤、烘干得到硫酸铅粉末,滤液3中含有HCl及硫酸.
(1)FeCl3与PbS反应生成PbCl2和S,Pb元素化合价不变,S元素化合价升高,则铁元素的化合价降低,有FeCl2生成,反应方程式为:2FeCl3+PbS=PbCl2+S+2FeCl2,
Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的PH值分别为3.2、7.04,加入盐酸的主要目的是为了控制PH值在0.5~1.0,抑制Fe3+、Pb2+的水解,
故答案为:2FeCl3+PbS=PbCl2+S+2FeCl2;抑制Fe3+、Pb2+的水解;
(2)加饱和食盐水、趁热过滤,利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解,
故答案为:利于PbCl2(s)+2Cl-(aq)?PbCl4-△H>0正向进行,使PbCl2溶解;
(3)过氧化氢将滤液2中Fe2+氧化为Fe3+,再循环利用,
故答案为:将滤液2中Fe2+氧化为Fe3+,循环利用;
(4)Ksp(PbSO4)=1.08×10-8<Ksp(PbCl2)=1.6×10-5,结合沉淀的转化,PbCl2晶体转化为PbSO4沉淀是因为PbCl2中加入稀硫酸破坏了氯化铅的溶解平衡,使溶解平衡正向移动生成硫酸铅,反应的离子方程式为:PbCl2(s)+SO42-(aq)?PbSO4 (s)+2Cl-(aq),
故答案为:PbCl2(s)+SO42-(aq)?PbSO4 (s)+2Cl-(aq);
(5)铅蓄电池充电时为电解池,放电是为原电池,正极发生还原反应,PbO2在正极获得电子,硫酸条件下反应生成PbSO4与水,电极反应式为:PbO2+4H++SO42-+2e-=PbSO4+2H2O;
原电池总反应为:PbO2+Pb+2H2SO4=2PbSO4+2H2O,2mol硫酸反应时转移2mol电子,消耗的硫酸为5L×(1.5mol/L-1.3mol/L)=1mol,故转移电子为1mol,电解饱和氯化钠溶液,电解池总反应为:2NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$H2↑+Cl2+2NaOH,根据转移电子守恒,可知参加反应NaCl为1mol,生成H2、Cl2各0.5mol,故剩余溶液的质量为400g-0.5mol×(2g/mol+71g/mol)=363.5g,参加反应的NaCl的质量为1mol×58.5g/mol=58.5g,溶液中剩余NaCl为400g×$\frac{32g}{100g+32g}$-58.5g=38.5g,故剩余溶液中NaCl的质量分数为$\frac{38.5g}{363.5g}$×100%=10.6%,
故答案为:PbO2+4H++SO42-+2e-=PbSO4+2H2O;10.6%.
点评 本题考查物质制备实验方案、原电池与电解原理、化学计算等,正确理解制备工艺流程为解答关键,试题充分考查了学生的分析、理解能力及灵活应用所学知识的能力,难度中等.


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:填空题
 回答下列有机化学问题:
回答下列有机化学问题: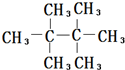 ;
;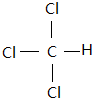 (写出一种).
(写出一种).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按如图装置进行如下实验,请用你所学知识完成下题:
按如图装置进行如下实验,请用你所学知识完成下题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2
现有下列十种物质:①H2 ②铁 ③CaO ④CO2 ⑤H2SO4 ⑥Ba(OH)2| 分类标准 | 金属单质 | 氧化物 | 溶液 | 电解质 |
| 属于该类的物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.
实验室用乙酸和正丁醇制备乙酸正丁酯.有关物质的相关数据如下表.| 化合物 | 相对分子质量 | 密度/g•cm-3 | 沸点/℃ | 溶解度/100g水 |
| 正丁醇 | 74 | 0.80 | 118.0 | 9 |
| 冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
| 乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+HCl↑ | B. | NH3+CO2+H2O═NH4HCO3 | ||
| C. | 2NaBr+Cl2═2NaCl+Br2 | D. | CuSO4+Fe═Cu+FeSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | r(S2-)>r(O2-)>r(F-) | B. | r(Al)>r(Mg)>r(Na) | C. | r(Na+)>r(O2-)>r(F-) | D. | r(Na)>r(Na+)>r(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应过程中,若增大压强能提高SiCl4的转化率 | |
| B. | 若反应开始时SiCl4为1mol,则达到平衡时,吸收热量为QkJ | |
| C. | 反应达平衡时,若升高温度,则硅的产量会提高 | |
| D. | 当反应吸收热量为0.025QkJ时,生成的HCl通入200mL 1mol•L-1的NaOH恰好反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每一个水分子内含有两个氢键 | |
| B. | 冰、水和水蒸气中都存在氢键 | |
| C. | 分子间形成的氢键使物质的熔点和沸点升高 | |
| D. | H2O是一种非常稳定的化合物,这是由于氢键所致 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com