
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:

下列说法错误的是:( )
A.反应达到平衡时,X的转化率为50%
B.反应可表示为X + 3Y 2Z,其平衡常数为1600
2Z,其平衡常数为1600
C.改变温度可以改变此反应的平衡常数
D.增大压强使平衡向生成Z的方向移动,平衡常数增大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届河北省沧州市高三上周测化学试卷(解析版) 题型:选择题
下列化学反应的离子方程式表示正确的是
A.向Na2SiO3溶液中通入过量CO2:SiO32-+CO2+H2O=H2SiO3↓+CO32-
B.向Ca(HCO3)2溶液中滴加少量Ba(OH)2溶液:Ca2++2HCO3-+Ba2++2OH一=CaCO3↓+BaCO3↓+2H2O
C.向NaHSO4溶液中加入Ba(OH)2溶液至中性:H++SO42―+Ba2++OH―=BaSO4↓++H2O
D.Fe(OH)2沉淀中滴加稀硝酸:Fe(OH)2+2H+=Fe2++2H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:推断题
已知A是石油裂解产生的一种气态烃,完全燃烧时产生的水和二氧化碳的物质的量之比为1:1。B和D是生活中常见的两种有机物。它们之间的相互转化关系如图所示。(反应条件未写出)
又知2CH3CHO+O2 2CH3COOH。请回答下列问题;
2CH3COOH。请回答下列问题;

(1)写出A的电子式 。
(2)B、D分子内含有的官能团分别是 、 (填名称)。
(3)写出下列反应的反应类型:② ④ 。
(4)写出下列反应的化学方程式:
① ;② ;④ ;⑤ 。
(5)燃烧92g的乙醇需要标准状况下的氧气体积为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
下列关于反应中,前者属于取代反应,后者属于加成反应的是
A.光照甲烷和氯气的混合物;乙烯使酸性高锰酸钾褪色
B.乙烯使溴的四氯化碳溶液褪色;苯与氢气在一定条件下反应生成环己烷
C.苯滴入浓硝酸和浓硫酸的混合液中并水浴加热;乙烯与水蒸气在一定条件下反应生成乙醇
D.在苯中滴入溴水,溴水褪色;乙烯使溴水褪色
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师大附中高二上第一次月考化学卷(解析版) 题型:填空题
2013年雾霾天气多次肆虐我国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径。目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g) △H>0。
CH3OCH3(g) + 3H2O(g) △H>0。
①写出该反应的平衡常数表达式 。
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 。
A.容器中密度不变
B.单位时间内消耗2molCO2,同时消耗1mol二甲醚
C.v(CO2)︰v(H2)=1︰3
D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g) + 2CO (g) 2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
2CO2 (g) + N2 (g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。据此判断:
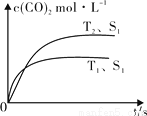
① 该反应的ΔH 0(选填“>”、“<”)。
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)已知:CO(g) + 2H2(g) CH3OH(g)△H = ﹣a kJ•mol-1。
CH3OH(g)△H = ﹣a kJ•mol-1。
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4 mol·L-1、c(H2)=0.4 mol·L-1、c(CH3OH)= 0.8 mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
0.8 mol·L-1, 则此时v正 v逆(填“>”、“<”或“=”)。
②某温度下,在体积固定的2L的密闭容器中将1 mol CO和2 mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则前15分钟,用氢气表示的平均化学反应速率为 ,达到平衡时CO的转化率为 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南师大附中高二上第一次月考化学卷(解析版) 题型:选择题
已知分解1mol H2O2放出热量98kJ,在含少量I﹣的溶液中,H2O2分解的机理为:
H2O2+I﹣→H2O+IO﹣ 慢
H2O2+IO﹣→H2O+O2+I﹣ 快
下列有关该反应的说法正确的是( )
A.反应速率与I﹣的浓度有关 B.IO﹣也是该反应的催化剂
C.反应活化能等于98kJ•mol﹣1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中把催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2+H2O= CO2+Pd↓+2HCl。下列说法正确的是
A.题述反应条件下还原性:CO>Pd
B.题述反应中PdCl2被氧化
C.生成22.4LCO2时,转移的电子为2mol
D.CO气体只有在高温下才能表现还原性
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上9.4周考化学试卷(解析版) 题型:选择题
下列过程属于固氮的是( )
A.NH3→NO B.NO→NO2 C.N2→NO D.N2→NH3
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖南省高二上第二次月考化学试卷(解析版) 题型:实验题
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
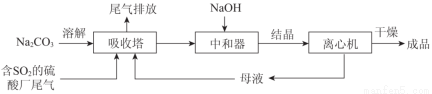
(1)举例说明向大气中排放SO2导致的环境问题:_________。
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。

(3)中和器中发生的主要反应的化学方程式是_________。
资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
A.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95 ~100℃加热浓缩,冷却至室温结晶
~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是: IO3-+
IO3-+ SO32- =
SO32- = _______ +
_______ + _______(将方程式补充完整)。
_______(将方程式补充完整)。
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com