

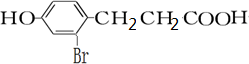 .
.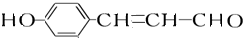 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$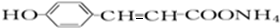 +2Ag↓+3NH3+H2O,反应类型为氧化反应.
+2Ag↓+3NH3+H2O,反应类型为氧化反应.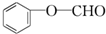 ,
,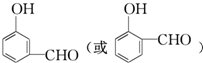 .
. +2nH2O.
+2nH2O. 分析 A能发生显色反应说明A中含有酚羟基,A能和银氨溶液反应说明含有醛基;A发生银镜反应生成C、C酸化生成D、D发生加成反应生成E,A中含有醛基和酚羟基,则A中至少含有2个O原子,则从A到E碳原子个数不变、O原子个数增多1个、H原子个数增多2个,则A的分子式为C9H8O2,A的不饱和度=$\frac{9×2+2-8}{2}$=6,苯环的不饱和度为4、醛基的不饱和度为1,则A中还含有一个碳碳双键;
A和2mol氢气发生加成反应生成B,B中不含甲基,则A的结构简式为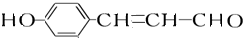 ,B结构简式为
,B结构简式为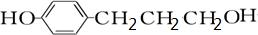 ,A中醛基被氧化生成羧酸铵,C结构简式为
,A中醛基被氧化生成羧酸铵,C结构简式为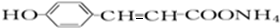 ,C酸化得到D,D结构简式为
,C酸化得到D,D结构简式为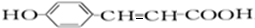 ,D和1mol氢气发生加成反应生成E,E结构简式为
,D和1mol氢气发生加成反应生成E,E结构简式为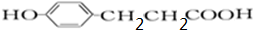 ,E和溴发生取代反应生成F,F仅有一种结构,结合F分子式知F结构简式为
,E和溴发生取代反应生成F,F仅有一种结构,结合F分子式知F结构简式为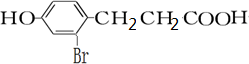 ,据此分析解答.
,据此分析解答.
解答 解:A能发生显色反应说明A中含有酚羟基,A能和银氨溶液反应说明含有醛基;A发生银镜反应生成C、C酸化生成D、D发生加成反应生成E,A中含有醛基和酚羟基,则A中至少含有2个O原子,则从A到E碳原子个数不变、O原子个数增多1个、H原子个数增多2个,则A的分子式为C9H8O2,A的不饱和度=$\frac{9×2+2-8}{2}$=6,苯环的不饱和度为4、醛基的不饱和度为1,则A中还含有一个碳碳双键;
A和2mol氢气发生加成反应生成B,B中不含甲基,则A的结构简式为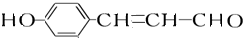 ,B结构简式为
,B结构简式为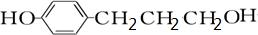 ,A中醛基被氧化生成羧酸铵,C结构简式为
,A中醛基被氧化生成羧酸铵,C结构简式为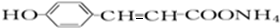 ,C酸化得到D,D结构简式为
,C酸化得到D,D结构简式为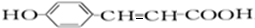 ,D和1mol氢气发生加成反应生成E,E结构简式为
,D和1mol氢气发生加成反应生成E,E结构简式为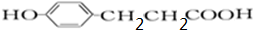 ,E和溴发生取代反应生成F,F仅有一种结构,结合F分子式知F结构简式为
,E和溴发生取代反应生成F,F仅有一种结构,结合F分子式知F结构简式为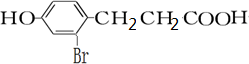 ,
,
(1)通过以上分析知,A的分子式为C9H8O2,F结构简式为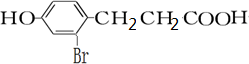 ,
,
故答案为:C9H8O2;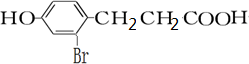 ;
;
(2)A的结构简式为 、C结构简式为
、C结构简式为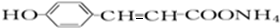 ,A发生银镜反应生成C,反应方程式为
,A发生银镜反应生成C,反应方程式为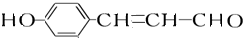 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$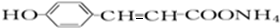 +2Ag↓+3NH3+H2O,该反应为氧化反应,
+2Ag↓+3NH3+H2O,该反应为氧化反应,
故答案为: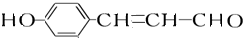 +2[Ag(NH3)2]OH$\stackrel{△}{→}$
+2[Ag(NH3)2]OH$\stackrel{△}{→}$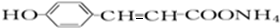 +2Ag↓+3NH3+H2O;氧化反应;
+2Ag↓+3NH3+H2O;氧化反应;
(3)B为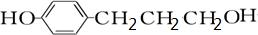 ,B的同分异构体符合下列条件:①1mol物质最多能消耗3molBr2②苯环上只有两个取代基③分子中只出现一个-CH3的结构,
,B的同分异构体符合下列条件:①1mol物质最多能消耗3molBr2②苯环上只有两个取代基③分子中只出现一个-CH3的结构,
如果取代基为-OH、-CH2CH(OH)CH3且二者处于间位时符合条件,有一种结构,;
如果取代基为-OH、-CH(OH)CH2 CH3且二者处于间位时符合条件,有一种结构;
如果取代基为-OH、-CH(CH3)CH2OH且二者处于间位时符合条件,有一种结构;
所以符合条件的有三种同分异构体,
故答案为:3;
(4)一定条件下R1CH═CHR2→R1CHO+R2CHO,A在一定条件下氧化生成X、Y(A中酚羟基已被保护),X的分子式为C7H6O2,它是芳香族化合物,X为 ,Y可进一步氧化得到一种还原性的二元羧酸,Y为OHCCHO,
,Y可进一步氧化得到一种还原性的二元羧酸,Y为OHCCHO,
①X为 ,X的同分异构体中含有醛基,其同分异构体中可能存在-CHO、-OH且二者位于邻位或间位,可能存在-O-CHO,符合条件的结构简式有
,X的同分异构体中含有醛基,其同分异构体中可能存在-CHO、-OH且二者位于邻位或间位,可能存在-O-CHO,符合条件的结构简式有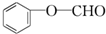 、
、 ,
,
故答案为: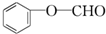 ;
; ;
;
②Y被氧化得到的乙二酸与乙二醇发生酯化反应形成高分子化合物的化学方程式为
nHOCH2CH2OH+nHOOC-COOH$?_{△}^{浓硫酸}$ +2nH2O,
+2nH2O,
故答案为:nHOCH2CH2OH+nHOOC-COOH$?_{△}^{浓硫酸}$ +2nH2O.
+2nH2O.
点评 本题考查有机物推断,侧重考查学生分析推断能力,为高考高频点,正确推断A的结构简式是解本题关键,再结合反应物的量、反应条件、某些物质的分子式进行推断,难点是同分异构体种类的判断,注意乙二酸和乙二醇发生缩聚反应中水的计量数,为易错点.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.06mol•L-1•min-1 | B. | 0.001mol•L-1•s-1 | ||
| C. | 0.04mol•L-1•min-1 | D. | 0.0005mol•L-1•s-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
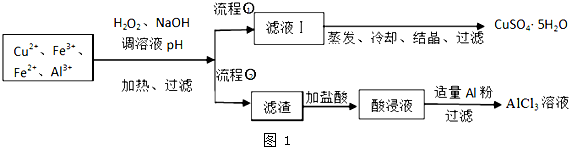
| 离子 | Fe3+ | Fe2+ | Al3+ | Cu2+ |
| pH范围 | 2.2~3.2 | 5.5~9.0 | 4.1~5.0 | 5.3~6.6 |
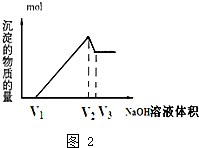
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 成份 | 浓度/(mol•L-1) | 质量分数 |
| HCl FeCl2 FeCl3 | -- 1.920 0.071 | 5.00% 8.94% 0.33% |
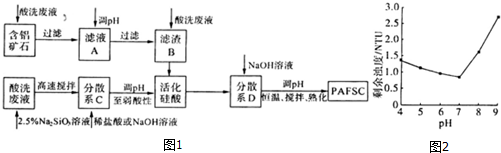
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5.0 m o l/L | B. | 4.0 m o l/L | C. | 4.5 m o l/L | D. | 3.0 m o l/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ②③④⑤⑥ | C. | ④⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对于元素周期表和元素周期律的发现有突出贡献的科学家是阿伏加德罗 | |
| B. | 元素周期表根据相对原子质量从小到大的顺序排列 | |
| C. | 现常见的元素周期表有七个横行,分为七个周期,有18个纵行,分为16个族 | |
| D. | 每一周期都是从金属元素开始,非金属元素结束 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外电子是分层运动的,像卫星一样有确定的轨道 | |
| B. | 所有电子在同一区域里运动 | |
| C. | 能量高的电子在离核近的区域运动 | |
| D. | 能量低的电子在离核近的区域运动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com