
【题目】金、银、铜、铁、铝和钛均是人类生产和生活中大量使用的金属。试回答与上述金属原子结构有关的问题:
(1)上述金属元素中属于主族元素的是__________________ 。
(2)钛被称为继铁、铝之后的“第三金属”。基态钛原子价电子轨道表示式为__________________ 。
(3)基态金原子的价电子排布式为![]() ,试判断金在元素周期表中位于第__________________ 周期第__________________族。
,试判断金在元素周期表中位于第__________________ 周期第__________________族。
(4)已知Ag与Cu位于同一族,则Ag在元素周期表中位于__________________区。
【答案】铝  六 ⅠB ds
六 ⅠB ds
【解析】
(1)铝属于主族元素;
(2)钛基态原子核外电子排布式为1s22s22p63s23p63d24s2,其外围电子排布式为3d24s2;
(3)电子排布式中能层数与周期数相等,外围电子排布式为(n-1)d10ns1的原子位于第IB族;
(4)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区。
(1)铝位于第三周期第ⅢA族,属于主族元素,金、银、铜、铁和钛都不属于主族元素,故答案为:Al;
(2)钛基态原子核外电子排布式为1s22s22p63s23p63d24s2,其外围电子排布式为3d24s2,则其外围电子的电子排布图为: ,故答案为:
,故答案为: ;
;
(3)电子排布式中最大能层数与周期数相等,外围电子排布式为(n-1)d10ns1的原子位于第IB族,基态金原子的外围电子排布式为5d106s1,该原子最大能层数是6,所以金原子位于第六周期第ⅠB族,故答案为:六;ⅠB;
(4)ⅠA、ⅡA族最后填充s电子,为s区;ⅢA~零族为p区,第ⅢB~ⅤⅡB族和第ⅤⅢ为d区;ⅠB和ⅡB族为ds区,Ag与Cu位于同一族,属于第ⅠB族,所以属于ds区,故答案为:ds。


科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是

A. 原子半径:W<X
B. 常温常压下,Y单质为固态
C. 气态氢化物热稳定性:Z<W
D. X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101 kPa下,2g氢气燃烧生成液态水,放出285.8kJ热量,表示该反应的热化学方程式正确的是( )
A. 2H2(g)+O2(g) == 2H2O(1) △H= ―285.8kJ/mol![]()
B. 2H2(g)+ O2(g) == 2H2O(1) △H= +571.6 kJ/mol
C. 2H2(g)+O2(g) == 2H2O(g) △H= ―571.6 kJ/mol
D. H2(g)+1/2O2(g) == H2O(1) △H= ―285.8kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是( )

A.该反应的化学方程式为3B+2D![]() 6A+4C
6A+4C
B.反应进行到1s时,v(A)=3v(D)
C.反应进行到6s时,各物质的反应速率相等
D.反应进行到6s时,B的平均反应速率为0.05mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原子核外电子排布与元素在周期表中位置关系的叙述正确的是( )
A.基态原子核外N电子层上只有一个电子的元素一定是第ⅠA族元素
B.原子核外价电子排布式为![]() 的元素一定是副族元素
的元素一定是副族元素
C.基态原子的p能级上半充满的元素原子的价电子排布式为![]()
D.基态原子核外价电子排布式为![]() 的元素的族序数一定为x+y
的元素的族序数一定为x+y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚维酮碘的水溶液是一种常用的碘伏类缓释消毒剂,聚维酮通过氢键与HI3形成聚维酮碘,其结构表示如图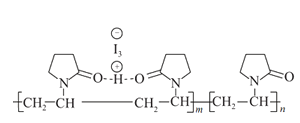 ,下列说法不正确的是( )
,下列说法不正确的是( )
A.聚维酮的单体是![]() B.聚维酮分子由(m+n)个单体聚合而成
B.聚维酮分子由(m+n)个单体聚合而成
C.聚维酮碘是一种水溶性物质D.聚维酮在一定条件下能发生水解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素及其化合物的应用研究是目前科学研究的前沿之一。试回答下列问题:
(1)二氧化钛(![]() )作光催化剂,能将污染物如甲醛(
)作光催化剂,能将污染物如甲醛(![]() )、苯等有害气体转化为二氧化碳和水。水分子的中心原子的价电子对数为__________;甲醛的价电子对互斥理论模型为__________;二氧化碳分子中碳原子的杂化类型为____________________。
)、苯等有害气体转化为二氧化碳和水。水分子的中心原子的价电子对数为__________;甲醛的价电子对互斥理论模型为__________;二氧化碳分子中碳原子的杂化类型为____________________。
(2)写出下列分子或离子的空间构型:![]() __________;
__________;![]() __________。
__________。
(3)![]() 可与
可与![]() 形成H3O+,H3O+中O原子采取杂化_________。H3O+中键角比H2O中键角大,原因是______________________________。
形成H3O+,H3O+中O原子采取杂化_________。H3O+中键角比H2O中键角大,原因是______________________________。
(4)原子序数小于36的过渡元素A和B,在元素周期表中位于同一族,且原子序数B比A多1,基态B原子中含有三个未成对电子。则B在元素周期表中的位置为__________,属于__________区元素,基态B原子的电子排布式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
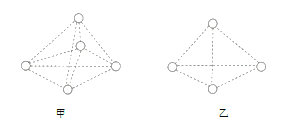
【题目】如图所示是甲烷和白磷![]() 分子的空间结构示意图,请你把认为是化学键的改为实线(在图上改即可)。把碳原子涂成实心小圆球_____。甲烷分子的空间结构是__________(填“甲”或“乙”)图。从图中可看出,每个甲烷分子中有__________对共用电子对,而白磷分子中形成__________个共价键。
分子的空间结构示意图,请你把认为是化学键的改为实线(在图上改即可)。把碳原子涂成实心小圆球_____。甲烷分子的空间结构是__________(填“甲”或“乙”)图。从图中可看出,每个甲烷分子中有__________对共用电子对,而白磷分子中形成__________个共价键。
查看答案和解析>>
科目:高中化学 来源: 题型:
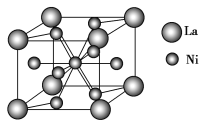
【题目】金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为____________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com