
| A.均存在电离平衡和水解平衡 |
| B.存在的粒子种类相同 |
| C.c(OH-)前者大于后者 |
D.分别加入NaOH固体,恢复到原温度,c(C )均增大 )均增大 |
科目:高中化学 来源:不详 题型:单选题
| A.阴极产物是氢气 | B.阳极产物是氧气 |
| C.阴极产物是铝和氧气 | D.阳极产物只有氯气 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(Na+)+c(H+)=c(HB-)+2c(B2-) | B.c(H+)·c(OH-)=10-14 |
| C.c(Na+)=c(B2-)+c(HB-) | D.溶液的pH=1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
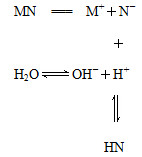
| A.MN是强电解质 |
| B.N-结合H+的能力一定比OH-强 |
| C.该过程中c(OH-)>c(H+) |
| D.溶液中存在c(HN)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡 常数(25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.c(HCN)<c(CN-) | B.c(Na+)> c(CN-) |
| C.c(HCN)=c(CN-)= c(Na+) | D.c(HCN)+c(CN-)="0.2" mol·L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com