
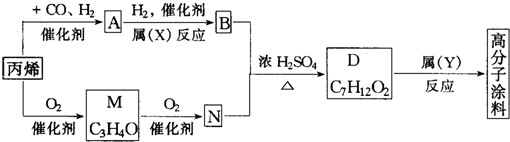
| 2×3+2-4 |
| 2 |
| 2×3+2-4 |
| 2 |
| 浓硫酸 |
| △ |
| 浓硫酸 |
| △ |


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
| A、V(碱)=102V(酸) |
| B、V(碱)=2 V(酸) |
| C、V(酸)=102V(碱) |
| D、V(酸)=2 V(碱) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 条 件 | 离子组 | 离子共存判断及反应的离子方程式 |
| A | 滴加氨水 | Na+、Al3+、Cl-、NO3- | 不能共存, Al3++3OH-═Al(OH)3↓ |
| B | pH=1的溶液 | Fe2+、Al3+、SO42-、MnO4- | 不能共存,5Fe2++MnO4-+8H+ ═Mn2++5Fe3++4H2O |
| C | 由水电离出的H+浓度为1×10-12 mol?L-1 | NH4+、Na+、NO3-、Cl- | 一定能共存, NH4++H2O═NH3?H2O+H+ |
| D | 通入少量SO2气体 | K+、Na+、ClO-、SO42- | 不能共存,2ClO-+SO2+H2O═ 2HClO+SO32- |
| A、A | B、B | C、C | D、C |
查看答案和解析>>
科目:高中化学 来源: 题型:
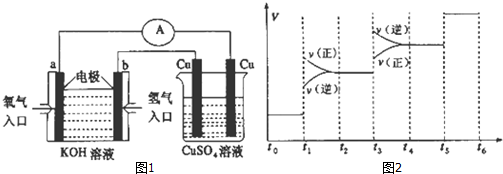
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、此一元弱酸的电离常数(Ka)约为1.0×10-6 |
| B、此弱酸的浓度为1×10-4mol/L |
| C、此实验最好选用甲基红(变色范围在4.2~6.3)作指示剂 |
| D、此滴定反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
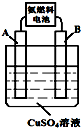 以氨气代替氢气研发氨燃料电池是当前科研的一个热点.
以氨气代替氢气研发氨燃料电池是当前科研的一个热点.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
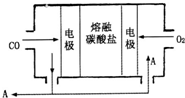 钠及其化合物具有广泛的用途.
钠及其化合物具有广泛的用途.| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
| 离子 | Fe2+ | Cu2+ | Mg2+ |
| pH | 7.6 | 5.2 | 10.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验顺序 | 实验内容 | 实验现象 |
| ① | A+B | 无现象 |
| ② | B+D | 有气体放出 |
| ③ | C+B | 有沉淀生成 |
| ④ | A+D | 有沉淀生成 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com