
【题目】某校兴趣小组用如图Ⅰ装置制取漂白液(气密性已检验,试剂已添加),并研究其相关性质.
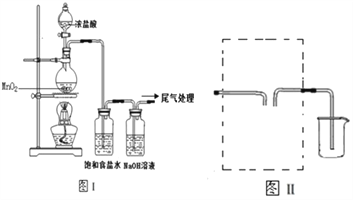
实验操作和现象:打开分液漏斗的活塞,缓缓滴加一定量浓盐酸,点燃酒精灯;一段时间后,关闭分液漏斗的活塞,熄灭酒精灯.
(1)烧瓶中反应的化学方程式是___________________。
(2)饱和食盐水的作用是___________________。
(3)若用图Ⅱ装置收集多余的氯气,请在虚线框内画出该装置简图_____。
(4)该小组同学用上述装置制得的漂白液中NaClO的浓度偏低.
查阅资料:在溶液中发生反应:
(a)Cl2(g)+2NaOH(aq)═NaCl(aq)+NaClO(aq)+H2O(l)△H1=-101.1kJ/mol
(b)3NaClO(aq)═2NaCl(aq)+NaClO3(aq)△H2=-112.2kJ/mol
反应(a)的反应速率很快,反应(b)在室温下较慢,根据资料,请对图Ⅰ装置提出改进建议:______________________
(5)修改方案后,该小组同学制得了较高浓度的NaClO溶液.他们把漂白液和滴有酚酞的红色Na2SO3溶液混合后,得到无色溶液.
提出猜想:ⅰ.NaClO把Na2SO3氧化了
ⅱ.NaClO把酚酞氧化了
ⅲ.NaClO把Na2SO3和酚酞均氧化了
①下列实验方案中可以证明NaClO氧化了Na2SO3的是 (_____)
a.向混合后的溶液中加入过量盐酸
b.向混合后的溶液中加入过量盐酸,再加入氯化钡溶液
c.向混合后的溶液中加入过量硝酸,再加入硝酸银溶液
d.向混合后的溶液中加入氢氧化钡溶液,再加入过量盐酸
②为证明NaClO氧化了酚酞,可进行的实验是_____________。
【答案】 MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 除去氯气中的氯化氢
MnCl2+Cl2↑+2H2O 除去氯气中的氯化氢  将盛NaOH溶液的洗气瓶浸在冰水中 b d 向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化
将盛NaOH溶液的洗气瓶浸在冰水中 b d 向混合后的溶液中加入NaOH溶液,若溶液不变红说明酚酞已经被氧化;若溶液变红说明酚酞没有被氧化
【解析】试题分析:
(1)实验室常用二氧化锰和浓盐酸反应制取氯气,所以烧瓶中反应的化学方程式是MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O 。
MnCl2+Cl2↑+2H2O 。
(2)浓盐酸易挥发,制取的氯气中含有氯化氢和水蒸气,饱和食盐水的作用是除去氯气中的氯化氢。
(3)若用图Ⅱ装置收集多余的氯气,可以用排饱和食盐水法收集,该装置简图为 。
。
(4)由信息可知,反应(a)为放热反应,且反应速率很快,溶液的温度会升高;反应(b)也是放热反应,虽然在室温下较慢,但在较高温度下会加快,所以对图Ⅰ装置可提出如下改进建议:将盛NaOH溶液的洗气瓶浸在冰水中(降低溶液温度,减少副反应的发生)。
(5)①因为Na2SO3被氧化的产物一定是Na2SO4,所以我们可以设计实验检验溶液中有硫酸根离子。方案一:向混合后的溶液中加入过量盐酸,再加入氯化钡溶液,若有白色沉淀生成则证明有硫酸根离子;方案二:向混合后的溶液中加入氢氧化钡溶液,生成了白色沉淀,再加入过量盐酸,沉淀不能全部溶解,则证明溶液中有硫酸根离子。故实验方案中可以证明NaClO氧化了Na2SO3的是b d 。向混合后的溶液中加入过量盐酸不能检验硫酸根离子。向混合后的溶液中加入过量硝酸可以把亚硫酸钠氧化为硫酸钠,所以也不能用于检验硫酸根离子。
②为证明NaClO氧化了酚酞,可进行的实验是向混合后的溶液中加入NaOH溶液,若溶液不变红,说明酚酞已经被氧化;若溶液变红,说明酚酞没有被氧化。


科目:高中化学 来源: 题型:
【题目】将标准状况下1.68 L CO2通入含有2 g NaOH的水溶液中,完全反应并得到2 L碱性溶液.则对于该溶液表述正确的是
A. 2c(Na+)=3[c(HCO3-) +c(CO32-)+c(H2CO3)]
B. c(Na+)+c(H+ )=c(HCO3-)+2c(CO32-)+c(OH-)
C. HCO3-的电离程度大于HCO3-的水解程度
D. 存在的平衡体系只有:HCO3- +H2O![]() H2CO3+OH-,HCO3-
H2CO3+OH-,HCO3-![]() H++CO32-
H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上有一种加酶洗衣粉,即在洗衣粉中加入少量的碱性蛋白酶,它的催化活性很强,衣物的汗渍、血迹以及人体排放的蛋白质油渍等遇到它,皆能水解而除去。下列衣料中不能用加酶洗衣粉洗涤的是( )。
①棉织品 ②毛织品 ③腈纶织品 ④蚕丝织品 ⑤涤纶织品 ⑥尼龙织品
A.①②③
B.②④
C.③④⑤
D.③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】称取两份铝粉,第一份中加入足量的盐酸,第二份中加入足量的烧碱,若同温同压下放出相同体积的气体,则两份铝粉的质量比为
A. 2:3 B. 1:6 C. 1:1 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知蓝色硫酸铜溶液会跟无色溴离子作用,生成绿色的四溴合铜离子: CuSO4(aq蓝色)+4KBr(aq)![]() K2[CuBr4](aq绿色)+K2SO4(aq),当温度升高时,该溶液中四溴合铜离子的浓度增大,所以溶液呈绿色。下列说法正确的是
K2[CuBr4](aq绿色)+K2SO4(aq),当温度升高时,该溶液中四溴合铜离子的浓度增大,所以溶液呈绿色。下列说法正确的是
A. 加入K2SO4溶液,平衡向左移动 B. 加水平衡不移动
C. 加入K2SO4固体,平衡向左移动 D. 正反应放热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将4 mol PCl3和2 mol Cl2充入容积不变的密闭容器中,在一定条件下反应:PCl3+Cl2PCl5,各物质均为气态。达平衡后,PCl5为0.8 mol。若此时再移走2 mol PCl3和1 mol Cl2,相同温度下达到平衡,PCl5的物质的量为
A. 0.8 mol B. 0.4 mol C. 0.4 mol<x<0.8 mol D. <0.4 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com