
【题目】为了说明稀硝酸与铜反应产生无色的一氧化氮气体,某同学设计了如图所示的实验装置。实验时,将分液漏斗的活塞打开,从U形管的长管口B注入稀硝酸,一直到U形管的短管口A单孔塞下沿且液面不再留有气泡为止。关闭活塞,并用酒精灯在U形管短管下微热。当铜丝上有气泡产生时,立即撤去酒精灯。试回答:

(1)反应一段时间后,除了可以观察到铜丝逐渐溶解,有气泡产生,还会出现的现象有________。
(2)反应结束后,若将活塞缓缓打开,分液漏斗内有何现象______________。
(3)写出生成一氧化氮的离子方程式:____________________________。
【答案】(1)溶液逐渐变蓝;A处液面下降,B处液面上升(2分)
(2)产生红棕色气体 (1分)
(3)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (2分)
【解析】
试题分析:(1)关闭活塞,并用酒精灯在U形管短管下微热,发生Cu与稀硝酸的反应生成硝酸铜和NO,反应一段时间观察到U型管内因不溶性气体NO的生成而产生压强差,A处液面下降,B处液面上升;反应生成硝酸铜,溶液颜色变为蓝色;
(2)如果再将分液漏斗的活塞慢慢打开,右侧压强大于左侧,U型管B侧管中硝酸又回落到A侧管内,NO与空气接触而生成红棕色气体;
(3)金属铜可以和稀硝酸反应生成硝酸铜、一氧化氮和水,根据原子守恒、电子守恒及电荷守恒,可得反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O。


科目:高中化学 来源: 题型:
【题目】某烃X完全燃烧时,生成的n(H2O)=n(CO2),X不能使溴水褪色。X的分子式可能是
A.C2H2 B.C2H4 C.C3H4 D.C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X2-与Y+离子都与Ar原子具有相同的核外电子排布,则下列叙述中正确的是
A. 原子序数X>Y
B. 离子半径X>Y
C. X和Y一定在同一周期
D. X是第IIA族元素,Y是第VIIA族元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单晶硅是信息产业中重要的基础材料。通常用炭在高温下还原二氧化硅制得粗硅(含铁、铝、硼、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450~500℃ ),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。

相关信息:① 四氯化硅遇水极易水解;② SIC14沸点为57.7℃ ,熔点为-70.0℃ 。请回答:
(1)写出装置A 中发生反应的离子方程式_______________。
(2)装置C 中的试剂是___________;装置F的作用是_______________;
装置E 中的h 瓶需要冷却的理由是_______________。
(3)装置E 中h 瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中含有铁元素,为了分析残留物中铁元素的含量,先将残留物预处理,使铁元素还原成Fe2+,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定。
① 反应的离子方程式:_______________。② 滴定前是否要滴加指示剂?_______________。(填“是”或“否”) ,请说明理由_______________。
③ 滴定前检验Fe3+ 是否完全还原的实验操作是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法正确的是( )
A. 将浓硝酸保存在无色玻璃瓶中 B. 金属钠和钾保存在煤油中
C. Na2CO3可以保存在玻璃塞的玻璃瓶中 D. NaOH固体放在滤纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、离子液体是一种室温熔融盐,为非水体系,由有机阳离子、Al2Cl7-和AlCl4-组成的离子液体作电解液时,可在钢制品上电镀铝。(9分)
(1)为测定镀层厚度,用NaOH溶液溶解钢制品表面的铝镀层,当反应转移6 mol电子时,所得还原产物的物质的量为________mol。(2分)
(2)用铝粉和Fe2O3做铝热反应实验,需要的试剂还有________。(2分)
a.KCl b.KClO3 c.MnO2 d.Mg
取少量铝热反应所得的固体混合物,将其溶于足量稀H2SO4,滴加KSCN溶液无明显现象,________(填“能”或“不能”)说明固体混合物中无Fe2O3,理由是_____________________________________(用离子方程式说明)。(5分)
II、焊接钢铁时常用的焊药为氯化铵,其作用是消除焊接处的铁锈。发生的反应体系中共有六种物质:NH4Cl、FeCl3、N2、Fe2O3、Fe和X。(6分)
(1)根据题意,可判断出X是________(1分)(写化学式)。
(2)写出并配平该反应的化学方程式:_________________________;
(3)发生还原反应的物质是________,反应中2mol的氧化剂能_______(1分)(填“失去”或“得到”)_____mol电子。
(4)反应中被氧化产生了5.6L(标准状况)的气体时,被还原的物质的质量为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(化学式为:Na2S2O5):白色粉末,水溶液显酸性,受潮易分解,遇强酸则放出一种刺激性气味的气体。它是一种化工原料,常用作抗氧化剂。
工业上,常用湿法制作焦亚硫酸钠,湿法制作有三步,其中:
第一步:在饱和碳酸钠溶液中通入足量的SO2,调至PH=4.1,得亚硫酸氢钠;
第二步:……
第三步:……
根据上述内容,回答问题:
(1)焦亚硫酸钠中S的化合价为
(2)第一步化学方程式为:
(3)焦亚硫酸钠含量测定:取焦亚硫酸钠样品约0.15g ,于密封瓶中,加入0.05mol/L碘(I2)滴定液50ml,塞紧,振摇溶解后,加盐酸1ml,用0.1mol/L硫代硫酸钠(Na2S2O3)滴定液滴定,至近终点时,加淀粉指示液2ml,继续滴定至蓝色消失,用去硫代硫酸钠溶液VmL。并将滴定结果进行空白对比。
已知:每1ml碘滴定液(0.05mol/L)相当于4.750mg的Na2S2O5。
该反应有两个离子方程式,分别为:
a: 3H2O + S2O52- + 2I2 = 2SO42- + 4I- + 6H+
b: 5H2O + S2O32- + 4I2 = 2SO42- + 8I- + 10H+
①a反应中每消耗1mol还原剂转移 mol电子;
②滴定至终点时的判定方法是: ;
③焦亚硫酸钠的质量分数为(列式表示,不计算结果): (可能用到的相对分子质量:Na2S2O5=190)
④由于碘单质在水中溶解度低,因此碘滴定液通常用I2与KI混溶得到碘(KI3)滴定液。取12.7g碘单质和26.6g碘化钾加水50mL溶解后,加盐酸3滴,定容至1000mL。该碘(KI3)滴定液物质的量浓度为 ;该碘(KI3)滴定液与焦亚硫酸钠反应时具有 性(填“氧化”或“还原”)。[可能用到的相对原子质量:I=127、K=39]
查看答案和解析>>
科目:高中化学 来源: 题型:
 【题目】无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝的试剂瓶久置于潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用制得。某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。
【题目】无水氯化铝是白色晶体,易吸收水分,在178℃升华,装有无水氯化铝的试剂瓶久置于潮湿空气中,会自动爆炸并产生大量白雾。氯化铝常作为有机合成和石油工业的催化剂,并用于处理润滑油等。工业上由金属铝和氯气作用或由无水氯化氢气体与熔融金属铝作用制得。某课外兴趣小组在实验室中,通过下图装置制取少量纯净的无水氯化铝。
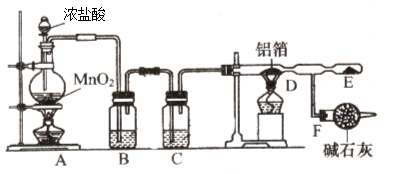

(1)A装置中发生反应的化学方程式为 ;
(2)B、C装置中应盛放的试剂名称分别为 、 ;
(3)从A装置导出的气体若不经过B、C装置而直接进入D管,将对实验产生的不良后果是 ;
(4)F装置所起的作用是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存并且溶液为无色透明的离子组是( )
A、Ca2+、Na+、NO3-、CO32- B、Mg2+、C1-、NH4+、SO42-
C、K+、Cl-、HCO3-、NO3- D、Ca2+、Na+、Fe2+、NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com