
| A、C H3COOH与CH3COONa的混合溶液中:c(CH3COO-)+c(OH-)=c(Na+)+c(H+) |
| B、常温下,0.1mol.L-1CH3COONa溶液和0.1mol.L-1NaHCO3溶液,NaHCO3溶液的pH大 |
| C、0.1mol.L-1的(NH4)2SO4溶液中:c(SO42-)>c(NH4+)>c(H+)>c(OH-) |
| D、将l mol KC1、l mol KHS溶于水配成的混合溶液中:n(K+)=n(S2-)+n(HS-)+n(H2S) |


 激活思维优加课堂系列答案
激活思维优加课堂系列答案 活力试卷系列答案
活力试卷系列答案科目:高中化学 来源: 题型:
| A、Cl2>I2>Fe3+>SO2 |
| B、Cl2>Fe3++>I2>SO2 |
| C、Fe3+>Cl2>I2>SO2 |
| D、Cl2>Fe3+>SO2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硬铝、碳素钢都是合金材料;合成纤维、光导纤维都是有机高分子化合物 |
| B、油脂在碱的作用下可发生水解,工业上利用该反应生产肥皂 |
| C、处理废水时可加入明矾作为混凝剂,以吸附水中的杂质 |
| D、推广可利用太阳能、风能的城市照明系统,发展低碳经济和循环经济,有利于改善环境质量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
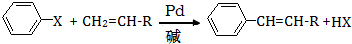 (X为卤原子,R为取代基)
(X为卤原子,R为取代基)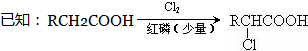
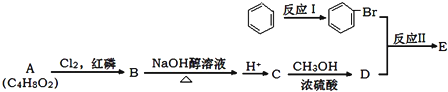
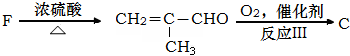
查看答案和解析>>
科目:高中化学 来源: 题型:
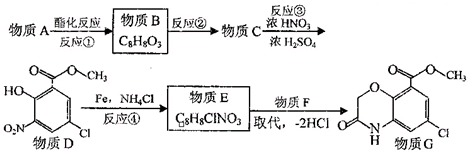
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、一氯甲烷和2-氯丙烷:正丁烷 |
| B、2,2-二甲基-1-氯丙烷与一氯甲烷:3,3-二甲基丁烷 |
| C、1,5-二氯戊烷:环戊烷 |
| D、四氯化碳:金刚石 |
查看答案和解析>>
科目:高中化学 来源: 题型:
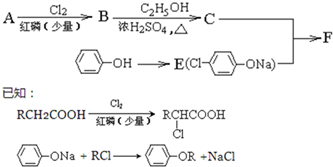
| NaOHC2H5OH |
| △ |
| 一定条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com