
| A. | X可能是Al单质 | B. | X可能是H2 | ||
| C. | 酸可能为H2SO4 | D. | 酸性氧化物可能为SiO2 |
分析 X和氧气反应生成酸性氧化物,且酸性氧化物能生成酸,且各反应通过一步反应得到,说明该氧化物能和水反应或其它物质反应得到酸,据此分析解答.
解答 解:A.Al和氧气反应生成Al2O3,Al2O3属于两性氧化物且不溶于水,故A错误;
B.氢气和氧气反应生成H2O而不是酸性氧化物,故B错误;
C.如果X是S或H2S,被氧化生成SO2,二氧化硫和溴水、氯水反应生成硫酸,发生反应SO2+Cl2+2H2O=H2SO4+2HCl,所以能一步实现,故C正确;
D.SiO2和水不反应,不能一步生成硅酸,需要先和强碱反应生成可溶性硅酸盐,然后硅酸盐和HCl反应生成硅酸,故D错误;
故选C.
点评 本题考查物质之间转化,侧重考查元素化合物知识及基本概念,明确物质性质是解本题关键,采用验证法分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:选择题
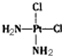 具有抗癌作用,而
具有抗癌作用,而 没有抗癌作用,对此下列叙述正确的是( )
没有抗癌作用,对此下列叙述正确的是( )| A. | 两者为同一物质,都是以Pt原子为中心的四面体结构 | |
| B. | 两者为同一物质,都是以Pt原子为中心的平面结构 | |
| C. | 两者互为同分异构体,都是以Pt原子为中心的四面体结构 | |
| D. | 两者互为同分异构体,都是以Pt原子为中心的平面结构 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乳酸CH3-CHOH-COOH | |
| B. | 脱氧核糖 CH2OH-CHOH-CHOH-CH2-CHO | |
| C. | 甘油CH2OH-CHOH-CH2OH | |
| D. | 核糖 CH2OH-CHOH-CHOH-CHOH-CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 +Br2$\stackrel{FeBr_{3}}{→}$
+Br2$\stackrel{FeBr_{3}}{→}$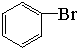 +HBr.
+HBr.| A. | ③④ | B. | ①② | C. | ②③ | D. | ①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:H2Se>H2S>H2O | B. | 原子半径:Se>S>Cl | ||
| C. | 酸性:H2SeO4>H2SO4>HClO4 | D. | 还原性:S2->Se2->Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是:CH4(g)+H2O(g)?CO(g)+3H2(g),其他条件相同,在不同催化剂(Ⅰ、Ⅱ)作用下反应相同时间后,体系中CO含量随反应温度的变化如图所示.下列说法正确的是( )| A. | 相同条件下,催化剂Ⅱ催化效率更高 | |
| B. | b点表示上述反应在对应条件下的平衡状态 | |
| C. | 根据图象,无法判断该反应是否为吸热反应 | |
| D. | 该反应平衡常数表达式为K=$\frac{c(CO)•{c}^{3}({H}_{2})}{c(C{H}_{4})}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

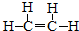 .
. CH3CH2COOC2H5+H2O,指出②的反应类型加成反应.
CH3CH2COOC2H5+H2O,指出②的反应类型加成反应. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体.
天然气的主要成分是甲烷,含有少量的羰基硫(COS)、乙硫醇(C2H5SH)等气体. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com