
已知:101 kPa时,1 mol辛烷完全燃烧生成CO2和液态水时放出热量为5 518 kJ,强酸与强碱在稀溶液中发生反应生成1 mol H2O时放出的热量为57.3 kJ,则下列热化学方程式书写正确的是( )
A.C8H18(l)+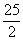 O2(g)====8CO2(g)+9H2O(g) ΔH=+5 518 kJ·mol-1
O2(g)====8CO2(g)+9H2O(g) ΔH=+5 518 kJ·mol-1
B.C8H18(l)+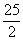 O2(g)====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
O2(g)====8CO2(g)+9H2O(l) ΔH=-5 518 kJ·mol-1
C.H++OH-====H2O ΔH=-57.3 kJ·mol-1
D.2NaOH(aq)+H2SO4(aq)====Na2SO4(l)+2H2O(l) ΔH=+57.3 kJ·mol-1
科目:高中化学 来源: 题型:
已知X、Y、Z、W四钟元素是元素周期表中连续三个不同短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的质子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍。试推断:
(1)X、Y、Z、W四种元素的名称:
X 、Y 、Z 、W
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为 ______、_____________________
(3)由X、Y、Z所形成的离子化合物是 ,它与W的最高氧化物的水化物的浓溶液加热时反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y两种金属,下列能说明X的金属性强于Y的金属性的组合是( )
①X的最高价氧化物的水化物的碱性强于Y的最高价氧化物的水化物的碱性
②X能置换出CuSO4溶液中的Cu,Y投入CuSO4溶液中无任何现象出现
③将X、Y用导线连接一起插入H2SO4溶液中,Y上冒大量气泡
④用碳棒电极电解含X、Y两种金属离子的盐溶液时,一开始析出的是金属Y
⑤X单质能从Y的硫酸盐溶液中置换出Y单质.
|
| A. | ①④⑤ | B. | ①②③⑤ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于下列各实验装置的叙述中,不正确的是
A.图①可用于实验室制备少量Cl2或NH3
B.可用从a处加水的方法检验装置②的气密性
C.实验室也可以用装置③收集HCl气体
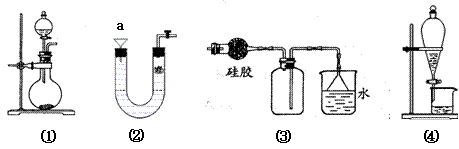 D.装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出
D.装置④可用于苯萃取碘水中碘的实验,并把碘的苯溶液从漏斗上口倒出
查看答案和解析>>
科目:高中化学 来源: 题型:
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: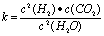 它所对应的化学反应为:
它所对应的化学反应为:
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所 需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1.2 | 3 |
①T1℃时,该反应的平衡常数K=
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度 (填选项字母)。
A. =0.8 mol·L-1 B. =1.4 mol·L-1 C. <1.4 mol·L-1 D. >1.4 mol·L-1
③丙容器的容积为1L,T1℃时,按下列配比充入C(s)、H2O(g)、CO2(g)和H2(g), 达到平衡时各气体的体积分数与甲容器完全相同的是 (填选项字母)。
A. 0.6 mol 1.0 mol 0.5 mol 1.0 mol B. 0.6 mol 2.0 mol 0 mol 0 mol
C. 1.0 mol 2.0 mol 1.0 mol 2.0 mol D. 0.25 mol 0.5 mol 0.75 mol 1.5 mol
(3)将燃煤废气中的CO2转化为甲醚的反应原理为:
 2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)
已知一定压强下,该反应在不同温度、不同投料比时,CO2的转化率见下表:
| 投料比[n(H2) / n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
①该反应的焓变△H 0,熵变△S 0(填>、<或=)。
②用甲醚作为燃料电池原料,在碱性介质中该电池负极的电极反应式 。
若以1.12 L·min-1(标准状况)的速率向该电池中通入甲醚(沸点为-24.9 ℃),用该电池电解500 mL 2 mol·L-1 CuSO4溶液,通电0.50 min后,理论上可析出金属铜
g。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与社会、生产、生活密切相关。下列说法正确的是
( )
A.石英只能用于生产光导纤维
B.从海水中提取物质都必须通过化学反应才能实现
C.为了增加食物的营养成分,可以大量使用食品添加剂
D.“地沟油”禁止食用,但可以用来制肥皂
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于能量转化的认识中错误的是( )
A.电解水生成氢气和氧气时,电能转化为化学能
B.绿色植物进行光合作用时,太阳能转化为化学能
C.电池充电是将电能转化为化学能
D.燃料电池的能量转化率可达100%
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.钢铁工业是国家工业的基础。请回答在钢铁腐蚀、防护过程中的有关问题。
(1)请写出钢铁在碱性、潮湿的环境下发生电化学腐蚀正极的电极反应式:
;
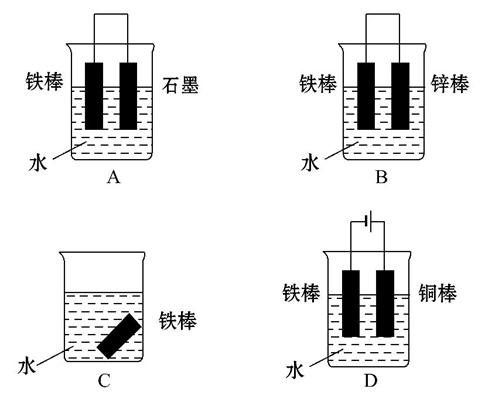
(2)下列哪个装置示意图可防止铁棒被腐蚀 。
Ⅱ.某小组为研究电化学原理,设计如图装置。请回答下列问题:
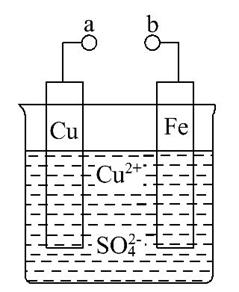
(1)a和b不连接时,铁片上发生反应的离子方程式为 ,
此时能量转化形式主要是化学能转化为 能。
(2)a和b用导线连接时,外电路中的电子是从 (填“Fe”或“Cu”)电极流出, (填“Cu2+”或“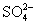 ”)向负极移动,铜极发生反应的电极反应式为 。
”)向负极移动,铜极发生反应的电极反应式为 。
(3)现在要在铁片上镀一层金属铜,则a极要和直流电源的 (填“正极”或“负极”)连接;此时铜片上发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
两种气态烃以一定比例混合,在105℃时1L该混合烃与9L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10L.下列各组混合烃中不符合此条件的是( )
|
| A. | CH4 C2H4 | B. | CH4 C3H6 | C. | C2H4 C3H4 | D. | C2H2 C3H6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com