
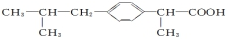
 +HCl
+HCl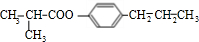 ��HCH2=C��CH3��COOH��
��HCH2=C��CH3��COOH��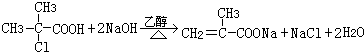 ��
������ �춡�����Ậ���Ȼ���������������ʣ����б������б���һЩ���ʣ����ӱ�����Cԭ���Ϻ���Hԭ�ӣ����Ա����Ը�������������춡����̼ԭ�Ӳ����ܹ��棬����1mol CxHyOz�ĺ���Ϊ��x+$\frac{y}{4}$-$\frac{z}{2}$��mol��
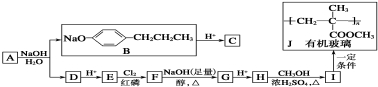
���л�����J�Ľṹ�� ����֪��I�����Ӿ۷�Ӧ����J����IΪCH2=C��CH3��COOCH3��H��״�����������Ӧ����I����HΪCH2=C��CH3��COOH��E�������ں��������·�Ӧ����F��F���������ƴ���Һ����������������G��G�ữ����CH2=C��CH3��COOH����GΪCH2=C��CH3��COONa����Ϸ�Ӧ��Ϣ��֪��FΪ��CH3��2CClCOOH��EΪ��CH3��2CHCOOH��D�ữ����E����DΪ��CH3��2CHCOONa��Aˮ������B��C����AΪ
����֪��I�����Ӿ۷�Ӧ����J����IΪCH2=C��CH3��COOCH3��H��״�����������Ӧ����I����HΪCH2=C��CH3��COOH��E�������ں��������·�Ӧ����F��F���������ƴ���Һ����������������G��G�ữ����CH2=C��CH3��COOH����GΪCH2=C��CH3��COONa����Ϸ�Ӧ��Ϣ��֪��FΪ��CH3��2CClCOOH��EΪ��CH3��2CHCOOH��D�ữ����E����DΪ��CH3��2CHCOONa��Aˮ������B��C����AΪ ��B�ữ����C����CΪ
��B�ữ����C����CΪ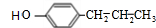 ���ݴ˽��
���ݴ˽��
��� �⣺��1��A���춡������������ͼ�����������ˮ�����ӳɷ�Ӧ����A����
B���ɽṹ��ʽ��֪������ʽΪC13H18O2����B��ȷ��
C���춡����̼ԭ�Ӳ����ܹ��棬��C����
D.1mol������ȫȼ����ҪO2Ϊ��13+$\frac{18}{4}$-$\frac{2}{2}$��mol=16.5mol����D��ȷ��
E���춡�����Ậ���Ȼ������Է���ȡ�����������кͷ�Ӧ�����б��������������������ӳɷ�Ӧ����E��ȷ��
��ѡ��AC��
��2�����л�����J�Ľṹ�� ����֪��I�����Ӿ۷�Ӧ����J����IΪCH2=C��CH3��COOCH3��H��״�����������Ӧ����I����HΪCH2=C��CH3��COOH��E�������ں��������·�Ӧ����F��F���������ƴ���Һ����������������G��G�ữ����CH2=C��CH3��COOH����GΪCH2=C��CH3��COONa����Ϸ�Ӧ��Ϣ��֪��FΪ��CH3��2CClCOOH��EΪ��CH3��2CHCOOH��D�ữ����E����DΪ��CH3��2CHCOONa��Aˮ������B��C����AΪ
����֪��I�����Ӿ۷�Ӧ����J����IΪCH2=C��CH3��COOCH3��H��״�����������Ӧ����I����HΪCH2=C��CH3��COOH��E�������ں��������·�Ӧ����F��F���������ƴ���Һ����������������G��G�ữ����CH2=C��CH3��COOH����GΪCH2=C��CH3��COONa����Ϸ�Ӧ��Ϣ��֪��FΪ��CH3��2CClCOOH��EΪ��CH3��2CHCOOH��D�ữ����E����DΪ��CH3��2CHCOONa��Aˮ������B��C����AΪ ��B�ữ����C����CΪ
��B�ữ����C����CΪ ��
��
I�к��еĹ�����Ϊ��̼̼˫����������
�ʴ�Ϊ��̼̼˫����������
��3���ɣ�2���з�����֪����ӦE��F�ǣ�CH3��2CHCOOH����������ȡ����Ӧ���ɣ�CH3��2CClCOOH��
��ӦI��J��CH2=C��CH3��COOCH3�����Ӿ۷�Ӧ���� ��
��
�ʴ�Ϊ��ȡ�����Ӿۣ�
��4���ɣ�2���з�����֪��A�Ľṹ��ʽΪ ��H�Ľṹ��ʽΪ��CH2=C��CH3��COOH��
��H�Ľṹ��ʽΪ��CH2=C��CH3��COOH��
�ʴ�Ϊ�� ��CH2=C��CH3��COOH��
��CH2=C��CH3��COOH��
��5��F��G�ķ�Ӧ����ʽΪ��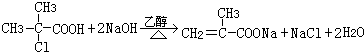 ��
��
�ʴ�Ϊ��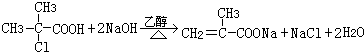 ��
��
��6��IΪCH2=C��CH3��COOCH3��I��һ��ͬ���칹�����㣺���ܹ�����ˮ�⣬˵���������������ܹ�����������Ӧ�����м����γɵ����������ں˴Ź�����������4���壬�ܲ�����״�ṹ��������̼̼˫��������������ͬ���칹��Ϊ��HCOOCH2C��CH3��=CH2��
�ʴ�Ϊ��HCOOCH2C��CH3��=CH2��
���� ���⿼���л�����ƶϣ��漰�л���Ľṹ�����ʡ���������ͬ���칹�����ޡ��л���Ӧ���͡��л���Ӧ����ʽ��д�ȣ��Ƕ���ѧ֪ʶ���ۺϿ��飬�����л������Ľṹ���������Ʒ������Ʒ����Ͻ��У�ע��Ը�����Ϣ��Ӧ�ã��ܽϺõĿ���ѧ�����Ķ���������˼ά���������ȵ����ͣ�


 ѧ���쳵�����ּ��ں�����ҵϵ�д�
ѧ���쳵�����ּ��ں�����ҵϵ�д� ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Al��OH��3+NaOH�TNaAlO2+2H2O | B�� | 2Na+2H2O�T2NaOH+H2�� | ||
| C�� | Na2O+CO2�TNa2CO3 | D�� | 2NaHCO3�TNa2CO3+CO2��+H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
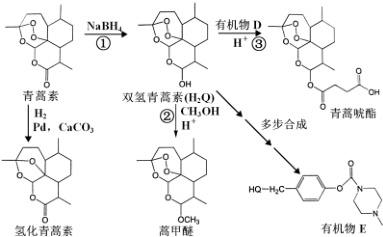
 ��
�� �⣬���躬�����Ķ��ǻ�������F��д���л���F��NaOH ��Һ��Ӧ�����ӷ�Ӧ����ʽ
�⣬���躬�����Ķ��ǻ�������F��д���л���F��NaOH ��Һ��Ӧ�����ӷ�Ӧ����ʽ ���л���G��F��ͬ���칹�壬�л���G��FeCl3��Һ����ɫ������ 4 �ֲ�ͬ���͵��⣬�������Ϊ3��2��2��1��������������л���G��ͬ���칹����3�֣�
���л���G��F��ͬ���칹�壬�л���G��FeCl3��Һ����ɫ������ 4 �ֲ�ͬ���͵��⣬�������Ϊ3��2��2��1��������������л���G��ͬ���칹����3�֣��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2��SO3��2SO2+O2�T2SO3 | |
| B�� | Fe��Fe2+��Fe+2H+�TFe2++H2�� | |
| C�� | Cl-��Cl2��2Cl-+I2�TCl2+2I- | |
| D�� | Cu��Cu��NO3��2��3Cu+8HNO3��Ũ���TCu��NO3��2+NO��+4H2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ӹ߹����̴ѣ�ʹ�̳��ͷ���Զ��ر� | |
| B�� | �ƹ�ʹ��ȼú����������ֹSO2��Ⱦ | |
| C�� | ��������Ч�ɳ���أ���չ�綯���� | |
| D�� | ����������ɫ��Դ�������ʯȼ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������O2��O3�������ͣ���O2��O3Ϊ���ȷ�Ӧ | |
| B�� | ��������O2��O3�������ߣ���O2��O3Ϊ���ȷ�Ӧ | |
| C�� | O3��O2�ȶ�����O2��O3Ϊ���ȷ�Ӧ | |
| D�� | O2��O3�ȶ�����O2��O3Ϊ���ȷ�Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ����и�����ѧ����������һ��ѧ�Ծ��������棩 ���ͣ������
FeCO3��ɰ�ǻ��ÿ�����Ѫ�����Ի���������(��CuO��Fe2O3��FeO��SiO2��Al2O3��)Ϊ��Ҫԭ���Ʊ�FeCO3���������£�
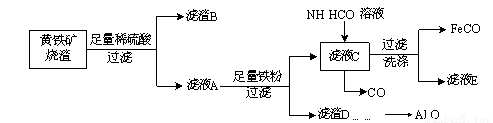
��1����������Ϊ30%���ܶ���1.176 g��cm��3����ϡ��������ʵ���Ũ��Ϊ ��
��2��������ҺA�д���Fe2+���Լ��� ��
��3�������������۵����ó�����pHʹAl3+ת��ΪAl(OH)3�����⣬�����������ã�д������һ����Ӧ�����ӷ���ʽ�� ��
��4��д����ҺC��NH4HCO3��Һ��Ӧ�����ӷ���ʽ�� ��
��5��FeCO3�ڿ��������տ��Ƶ���ϵ��������ϡ���֪25�棬101 kPaʱ��
4Fe(s)��3O2(g) 2Fe2O3 ��H����1648 kJ��mol��1
2Fe2O3 ��H����1648 kJ��mol��1
C(s)��O2(g) CO2(g) ��H����393 kJ��mol��1
CO2(g) ��H����393 kJ��mol��1
2Fe(s)��2C(s)��3O2(g) 2FeCO3(s) ��H����1480 kJ��mol��1
2FeCO3(s) ��H����1480 kJ��mol��1
д��FeCO3�ڿ�������������Fe2O3���Ȼ�ѧ����ʽ�� ��
��6��ij��ȤС��Ϊ������ø���Ʒ������������DΪԭ����ȡAl2O3���벹�����ʵ�鲽�裺������D�м�������NaOH��Һ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2017�콭��ʡ����и�����ѧ����������һ��ѧ�Ծ��������棩 ���ͣ�ѡ����
�����йػ�������������������
A��������ˮʹ������ɱ������ B����ȼú�м�������ʯ��ʯ������
C���ƹ�ʹ�ÿɽ������Ϸ�ֹ��ɫ��Ⱦ D���ᳫ�������пɼ��ٵ��������ŷ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com