
 (2011?琼海一模)向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )
(2011?琼海一模)向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中三种离子的物质的量之比为( )

科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
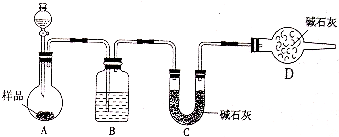
科目:高中化学 来源: 题型:
 (2011?琼海一模)1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )
(2011?琼海一模)1983年,福瑞堡大学的普林巴克(Prinzbach),合成多环有机分子.如图分子,因其形状像东方塔式庙宇(pagoda-style temple),所以该分子也就称为pagodane(庙宇烷),有关该分子的说法正确的是( )查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com