
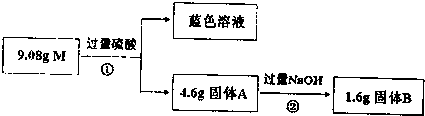
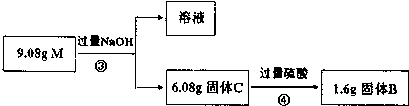
分析 9.08g固体与稀硫酸反应生成蓝色溶液,则溶液中含有Cu2+,因铜与稀硫酸不反应,则一定含有Fe2O3,首先发生Fe2O3+6H+═2Fe3++3H2O,然后发生Cu+2Fe3+═2Fe2++Cu2+,只有SiO2与稀硫酸不反应,则A为SiO2,加入过量NaOH,剩余固体B应为Cu,9.08g固体加入过量氢氧化钠,固体C应为Cu、Fe2O3,结合反应的离子方程式解答该题.
解答 解;9.08g固体与稀硫酸反应生成蓝色溶液,则溶液中含有Cu2+,因铜与稀硫酸不反应,则一定含有Fe2O3,首先发生Fe2O3+6H+═2Fe3++3H2O,然后发生Cu+2Fe3+═2Fe2++Cu2+,只有SiO2与稀硫酸不反应,则A为SiO2,加入过量NaOH,剩余固体B应为Cu,9.08g固体加入过量氢氧化钠,固体C应为Cu、Fe2O3,
(1)Fe203能与稀硫酸反应生成氯化铁,离子方程式:Fe2O3+6H+═2Fe3++3H2O,铜能与三价铁离子反应,离子方程式:Cu+2Fe3+═2Fe2++Cu2+,
故答案为:Fe2O3+6H+═2Fe3++3H2O、Cu+2Fe3+═2Fe2++Cu2+;
(2)反应②二氧化硅能与氢氧化钠的反应,反应生成硅酸钠,化学方程式是SiO2+2NaOH═Na2SiO3+H2O,
故答案为:SiO2+2NaOH═Na2SiO3+H2O;
(3)B加入过量氢氧化钠后剩余固体C,说明Fe2O3的量不足以使Cu全部被Fe3+氧化为Cu2+,目前可知B的成分为1.6gCu(0.025mol)和3.0gSiO2(0.5mol),这里SiO2的质量就是9.08g混合物中SiO2的质量.
重新测定知C中含有Fe2O3和Cu共6.08g,加上3.0gSiO2正好是9.08g,所以混合物中含有Fe2O3、Cu和SiO2.
设Fe2O3的质量为xg,那么它完全溶解在盐酸中生成$\frac{x}{80}$molFe3+,这些铁离子能将$\frac{x}{160}$molCu溶解,还剩余0.025molCu,
则x+($\frac{x}{160}$+0.025)×64=6.08,
解得x=3.2.
所以9.08g混合物中含有Fe2O33.2g,Cu 2.88g,SiO2 3.0g,
故答案为:Cu、SiO2、Fe2O3;m(Fe2O3):m(Cu):m(SiO2)=3.2:2.88:3.0.
点评 本题考查混合物成分的推断及计算,侧重于学生的分析、计算能力的考查,为高频考点,注意根据反应现象判断存在的物质,注意合理分析题中数据,根据题中数据及反应方程式计算出铜和氧化铁的物质的量.


科目:高中化学 来源: 题型:填空题
| 元素编号 | 元素性质或原子结构 |
| T | 最高正价与最低负价的代数和为4 |
| X | 最外层电子数是次电子数次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| Z | 最高正价是+7价 |
 ;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).
;Y的氢化物的水溶液显碱性的原因为NH3+H2O?NH3•H2O?NH4++OH-(用离子方程式表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
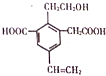
| A. | 1mol该物质,最多可以加成4molH2 | |
| B. | 该物质消耗Na、NaOH、NaHCO3的物质的量比为3:2:2 | |
| C. | 可以用酸性高锰酸钾溶液检验其中的碳碳双键 | |
| D. | 该物质能够在催化剂作用下被氧化为含醛基的化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 强碱性溶液中:K+、Al3+、Cl-、SO42- | |
| B. | 含有0.1 mol/L Fe3+的溶液中:K+、Mg2+、I-、Cl- | |
| C. | 含有0.1 mol/L Ca2+的溶液中:Na+、K+、SO42-、Cl- | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO-3、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
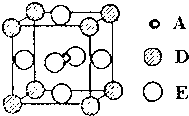 A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.
A、B、C、D和E都是元素周期表中前36号的元素,它们的原子序数逐渐增大.A原子核外电子有6种不同的运动状态,C的基态原子2p能级上有2个未成对电子,C2-离子与D2+离子具有相同的电子层结构,E的基态原子的外围电子排布式为3d84s2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素互为同分异构体 | |
| B. | 油脂没有固定的熔沸点 | |
| C. | 葡萄糖、果糖、蔗糖都能发生水解反应 | |
| D. | 糖类、油脂、蛋白质都是高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com