
【题目】关于下列各装置图的叙述中,不正确的是
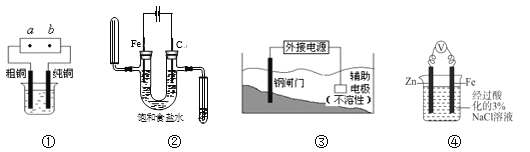
A. 用装置①精炼铜,则a极为电源正极,电解质溶液可为CuSO4溶液
B. 用湿润的淀粉-KI试纸检验装置②中阳极气体产物时,试纸变为蓝色
C. 装置③中钢闸门应与外接电源的负极相连,该保护法称为“牺牲阳极的阴极保护法”
D. 装置④中反应一段时间后,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀
【答案】C
【解析】
A.结合精炼铜的原理进行分析;
B.阳极产生氯气,遇湿润的淀粉-KI试纸变蓝;
C.图为外加电源的阴极保护法;
D.该装置中铁做正极,溶液中不存在亚铁离子,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀;
A.用装置①精炼铜,粗铜做阳极,精铜做阴极,a极为电源正极,电解质溶液可为CuSO4溶液,故A项正确;
B.装置②中氯离子在阳极放电生成氯气,遇湿润的淀粉-KI试纸变蓝,故B项正确;
C.钢闸门与外接电源的负极相连,图为外加电源的阴极保护法,故C项错误;
D.锌、铁形成的原电池中,锌做负极,铁做正极,溶液中不存在亚铁离子,取Fe电极附近溶液滴加铁氰化钾溶液,不会产生蓝色沉淀,故D项正确;
综上,本题选C。


科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当下列物理量不再变化时,不能表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.B的物质的量浓度B.混合气体的密度
C.混合气体的平均相对分子质量D.混合气体的压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下:

已知:i.部分离子完全生成氢氧化物沉淀的pH
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)为保证产物TiO(OH)2的纯度,加入试剂A要适量。试剂A为___________。
(2)煅烧回收的TiO(OH)2,获得的TiO2会发黄,发黄的杂质可能是_______(填化学式)。
(3)滤渣I的主要成分除Fe(OH)2、Al(OH)3外,还含有______________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:2[Fe(NH3)2]2+ +________+4H2O +H2O2 =_______ + 4NH3·H2O
(5)电解制备过二硫酸铵的装置如下图所示。

①S2O82-中S元素的化合价为+6,其中过氧键的数目为___________。
②电解时,铁电极连接电源的___________极。
③常温下,电解液中含硫微粒主要存在形式与 pH 的关系如下图所示。

在阳极放电的离子主要为HSO4-,阳极区电解质溶液的 pH 范围为______,阳极的电极反应式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写错误的是
A. HCO3-的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B. Cu2+的水解方程式:Cu2++2H2O![]() Cu(OH)2+2H+
Cu(OH)2+2H+
C. NH4+的水解方程式:NH4++2H2O![]() NH3·H2O+H3O+
NH3·H2O+H3O+
D. CaCO3的电离方程式:CaCO3![]() Ca2++CO32-
Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究Mg(OH)2的溶解平衡时,利用下表三种试剂进行试验,下列说法中不正确的是
编号 | ① | ② | ③ |
分散质 | Mg(OH)2 | HCl | NH4Cl |
备注 | 悬浊液 | 1 mol/L | 1 mol/L |
A. 向①中滴入几滴酚酞试液后,溶液显红色说明Mg(OH)2是一种弱电解质
B. 为了使Mg(OH)2悬浊液溶解得更快,加入过量的NH4Cl浓溶液并充分振荡,效果更好
C. ①、③混合后发生反应:Mg(OH)2(s)+2NH4+(aq)![]() Mg2+(aq)+2NH3·H2O(aq)
Mg2+(aq)+2NH3·H2O(aq)
D. 向①中加入②,H+与OH—反应生成H2O,使c(OH-)减小,Mg(OH)2溶解平衡向溶解方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业以软锰矿(主要成分是MnO2,含有SiO2、Fe2O3等少量杂质)为主要原料制备高性能的磁性材料碳酸锰(MnCO3)。其工业流程如下:

(1)浸锰过程中Fe2O3与SO2反应的化学方程式为Fe2O3+ SO2+2H+=2Fe2++ SO42-+ H2O,该反应是经历以下两步反应实现的。写出ⅱ的离子方程式:_____________。
ⅰ:Fe2O3 + 6H+ = 2Fe3++3H2O
ⅱ:……
(2)过滤Ⅰ所得滤液中主要存在的两种金属阳离子为_____________(填离子符号)。
(3)写出氧化过程中MnO2与SO2反应的化学方程式:_________________。
(4)“浸锰”反应中往往有副产物MnS2O6生成,温度对“浸锰”反应的影响如图所示,为减少MnS2O6的生成,“浸锰”的适宜温度是_________;向过滤Ⅱ所得的滤液中加入NH4HCO3溶液时温度不宜太高的原因是___________________。

(5)加入NH4HCO3溶液后,生成MnCO3沉淀,同时还有气体生成,写出反应的离子方程式:___________________。
(6)生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯M常用作调制具有草莓、葡萄、樱桃等香味的食用香精。M属于芳香化合物,苯环上只含一个直支链,能发生加聚反应和水解反应。测得M的摩尔质量为162 g·mol-1,只含碳、氢、氧三种元素,且原子个数之比为5∶5∶1。
(1)肉桂酸甲酯的结构简式是___________________________。
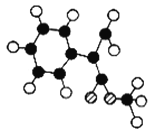
(2)G为肉桂酸甲酯的一种同分异构体,其分子结构模型如图所示(图中球与球之间连线表示单链或双键)。G的结构简式为_____________。
(3)以芳香烃A为原料合成G的路线如下:
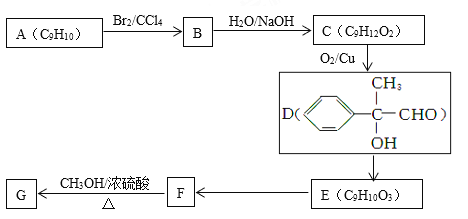
①化合物E中的含氧官能团有_____________(填名称)。
②E→F的反应类型是__________,F→G的化学方程式为______________________。
③符合下列条件的F的同分异构体中:
Ⅰ.分子内含苯环,且苯环上只有一个支链;不含“―O―O―”和“―C≡C―”;
Ⅱ.在催化剂作用下,1 mol该物质与足量氢气充分反应,消耗5 mol H2;
Ⅲ.它不能发生水解反应,不能发生酯化反应。
其中能与银氨溶液反应,且1mol该有机物与析出的银的物质的量之比为1∶4的是_________________________________(写结构简式);其中核磁共振氢谱图中有6个峰,且峰面积之比为1∶1∶1∶1∶2∶2的是 _________________________(写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积为2 L的密闭容器中,加入0.8 mol的A2气体和0.6 mol B2气体,一定条件下发生如下反应:A2(g)+B2(g)![]() 2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是
2AB(g) ΔH<0,反应中各物质的浓度随时间的变化情况如图所示,下列说法不正确的是

A. 图中a点的值为0.15 B. 该反应的平衡常数K=0.03
C. 温度升高,平衡常数K值减小 D. 平衡时A2的转化率为62.5%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】LiBH4为近年来储氢材料领域的研究热点。
(1)反应2LiBH4=2LiH+2B+3H2↑,生成22.4 L H2(标准状况)时,转移电子的物质的量为____mol。
(2)下图是2LiBH4/MgH2体系放氢焓变示意图,则:
Mg(s)+2B(s)=MgB2(s) △H=________。

(3)采用球磨法制备Al与LiBH4的复合材料,并对Al-LiBH4体系与水反应产氢的特性进行下列研究:
①如图为25℃水浴时每克不同配比的Al-LiBH4复合材料与水反应产生H2体积随时间变化关系图。由图可知,下列说法正确的是____(填字母)。

a.25℃时,纯铝与水不反应
b.25℃时,纯LiBH4与水反应产生氢气
c.25℃时,Al-LiBH4复合材料中LiBH4含量越高,1000s内产生氢气的体积越大
②如图为25℃和75℃时,Al-LiBH4复合材料[ω(LiBH4)=25%]与水反应一定时间后产物的X-射线衍射图谱(X-射线衍射可用于判断某晶态物质是否存在,不同晶态物质出现衍射峰的衍射角不同)。

从图中分析,25℃时Al-LiBH4复合材料中与水完全反应的物质是___________(填化学式),产生Al(OH)3的化学方程式为_________________。
(4)如图是直接硼氢化钠-过氧化氢燃料电池示意图。该电池工作时,正极附近溶液的pH________(填“增大”、“减小”或“不变”),负极的电极反应式为________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com