
| A. | Na+、Ba2+、NO3-、Cl- | B. | K+、Mg2+、Na+、SO42- | ||
| C. | CO32-、K+、Cl-、Na+ | D. | Cu2+、NO3-、SO42-、Na+ |
分析 A.电解时阳极氯离子放电生成黄绿色气体氯气;
B.电解时氢氧根离子放电生成无色的氧气,阴极氢离子得到电子生成氢气,同时生成氢氧根离子,氢氧根离子与镁离子生成氢氧化镁白色沉淀;
C.阳极氯离子放电生成氯气,氯气为黄绿色气体;
D.铜离子为有色离子.
解答 解:A.用惰性电极电解时,Cl-放电生成黄绿色的氯气,不是无色气体,故A错误;
B.电解时阳极K+、Mg2+、Na+、SO42-都不放电,氢氧根离子放电生成无色的氧气,阴极氢离子放电生成氢气,同时生成的氢氧根离子与Mg2+结合生成白色沉淀氢氧化镁,满足题干条件,故B正确;
C.用惰性电极电解时,Cl-放电生成黄绿色的氯气,不满足无色气体的要求,故C错误;
D.Cu2+为有色离子,不满足无色溶液的条件,故D错误;
故选B.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,明确电解原理为解答关键,注意题目所隐含的条件,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在,试题培养了学生的分析能力及灵活应用能力.


 永乾教育寒假作业快乐假期延边人民出版社系列答案
永乾教育寒假作业快乐假期延边人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 钙 | B. | 铁 | C. | 硅 | D. | 碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
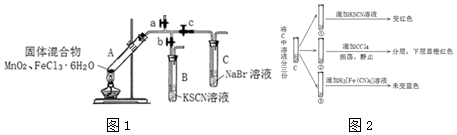
| 操作步骤 | 现象 |
| 1检查装置气密性,添加相应药品,点燃酒精灯,开始给A加热 | |
| 2打开a,关闭b、c,用湿润蓝色石蕊试纸贴近a口 | A中出现白雾,蓝色石蕊试纸变红 |
| 3打开b,关闭a、c | A中逐渐产生黄色气体,试管及导管壁内附有黄色液滴,B中溶液变红 |
| 4打开c,关闭a、b | C中溶液变棕黄色 |
| 5停止加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 +HNO3$\stackrel{浓硫酸}{→}$
+HNO3$\stackrel{浓硫酸}{→}$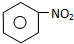 +H2O;③
+H2O;③ ;④
;④ .①③④均为取代反应(填反应类型).
.①③④均为取代反应(填反应类型). E
E .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氮化铝中氮元素的化合价为+3 | |
| B. | AlN的摩尔质量为41g | |
| C. | 上述反应中每生成1molAlN,N2就得到3 mol电子 | |
| D. | 在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20mL 12mol•L-1的盐酸 | B. | 10mL 18mol•L-1的硫酸 | ||
| C. | 80mL 2mol•L-1的硫酸 | D. | 40mL 14mol•L-1的硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 锌片为负极,稀硫酸是电解质溶液 | |
| B. | 电池工作时电子由锌片经导线流向铜片 | |
| C. | 电池工作时铜片逐渐溶解而质量减轻 | |
| D. | 电池工作时实现了化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 服用阿司匹林,身体出现水杨酸不良反应时,可静脉注射NaHCO3溶液 | |
| B. | 阿司匹林的分子式为C9H10O4 | |
| C. | 水杨酸可以发生取代、加成、氧化、加聚反应 | |
| D. | 1 mol阿司匹林最多可消耗2 mol NaOH |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com