
【题目】X、Y、Z、W有如下所示的转化关系,且△H=△H1+△H2 , 则X、Y可能是( )
①C,CO ②S,SO2 ③AlCl3、Al(OH)3 ④Na2CO3、NaHCO3 ⑤Fe、FeCl2 . ![]()
A.①②③④⑤
B.②④⑤
C.①③④
D.①②③
【答案】C
【解析】解:①由C+O2 ![]() CO2 , 可看成C+
CO2 , 可看成C+ ![]() O2
O2 ![]() CO、CO+
CO、CO+ ![]() O2
O2 ![]() CO2来完成,X、Y、Z的物质的量相等,符合△H=△H1+△H2,故①正确;
CO2来完成,X、Y、Z的物质的量相等,符合△H=△H1+△H2,故①正确;
②因S与氧气反应生成二氧化硫,不会直接生成三氧化硫,则不符合转化,故②错误;
③由AlCl3+4NaOH═3NaCl+NaAlO2+2H2O,可看成AlCl3+3NaOH═Al(OH)3↓+3NaCl、Al(OH)3+NaOH═NaAlO2+2H2O来完成,X、Y、Z的物质的量相等,符合△H=△H1+△H2,故③正确;
④由Na2CO3+2HCl═CO2+2NaCl+H2O,可看成Na2CO3+HCl═NaHCO3+NaCl,NaHCO3+HCl═CO2+NaCl+H2O来完成,X、Y、Z的物质的量相等,符合△H=△H1+△H2,故④正确;
⑤Fe和Cl2反应生成FeCl3 , 故⑤错误;
故选C.


 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案 启东小题作业本系列答案
启东小题作业本系列答案科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示.下列有关微生物电池的说法正确的是( ) 
A.b极为正极,发生氧化反应
B.外电路中电子的移动方向为:b→a
C.质子通过交换膜从b极区移向a极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化剂与还原剂的判断正确的是( )
A.反应CH4+2O2![]() CO2+2H2O中,O2是氧化剂,CH4是还原剂
CO2+2H2O中,O2是氧化剂,CH4是还原剂
B.反应Cl2+2NaOH=NaClO+NaCl+H2O中,Cl2是氧化剂,NaOH是还原剂
C.反应MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂
D.反应2Na+2H2O=2NaOH+H2↑中,H2O既是氧化剂又是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地壳中含量第一和第三的两元素形成的化合物不具有的性质是( )
A.熔点很高B.与铁在高温下发生放热反应
C.能溶于氢氧化钠溶液D.熔融后可以导电
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组的同学欲探究测定草酸晶体(H2C2O4xH2O)中x的值.通过查阅资料该小组同学得知:草酸易溶于水,其水溶液可以与酸性KMnO4溶液发生反应2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.该组同学利用该反应原理设计了滴定的方法测定x值.
①称取1.260g纯草酸晶体,将其制成100.00mL水溶液为待测液.
②取25.00mL待测液放入锥形瓶中,再加入适量的稀H2SO4
③用浓度为0.1000mol/L的KMnO4标准溶液进行滴定,实验记录有关数据如下:
滴定次数 | 待测草酸溶液体积(mL) | 0.1000mol/LKMnO4标准溶液体积(mL) | |
滴定前刻度 | 滴定后刻度 | ||
第一次 | 25.00 | 0.00 | 10.02 |
第二次 | 25.00 | 0.22 | 11.32 |
第三次 | 25.00 | 1.56 | 11.54 |
请回答: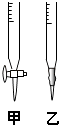
(1)滴定时,将KMnO4标准液装在右图中的(填“甲”或“乙”)滴定管中.
(2)本实验滴定达到终点的标志可以是 .
(3)通过上述数据,计算出x= .
(4)①若滴定终点时俯视滴定管刻度,则由此测得的x值会(填“偏大”、“偏小”或“不变”,下同).
②若滴定时所用的KMnO4溶液因久置而导致浓度变小,则由此测得的x值会 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知砒霜As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4=2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:。
(2)As2O3在上述反应中________。
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原
(3)该反应的氧化产物是 , 氧化剂是。
(4)若生成0.1 mol AsH3 , 则转移的电子数为。(用NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列每组分别给出了两个量,不可以求出相应物质的量的是
A | B | C | D |
物质微粒数 | 溶液的质量分数 | 标准状况下气体的摩尔体积 | 物质的质量 |
阿伏加德罗常数 | 溶液体积 | 标准状况下气体的体积 | 物质的摩尔质量 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种重要的可再生能源.
(1)2CH4(g)+O2(g)=2CO(g)+4H2(g)△H=a kJ/mol
CO(g)+2H2(g)=CH3OH(g)△H=b kJ/mol
写出由CH4和O2制取CH3OH(g)的热化学方程式: .
(2)甲图是反应时CO和CH3OH(g)的物质的量浓度随时间(t)的变化曲线.从反应开始至达到平衡时,用H2表示的反应速率v(H2)= . 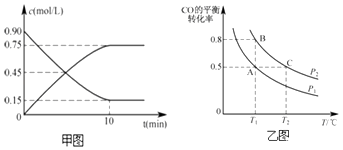
(3)在一容积可变的密闭容器中充入10mol CO和20mol H2 , 发生上述反应并达到平衡,CO的平衡转化率随温度(T)、压强(P)的变化曲线如乙图所示.
能判断该反应达到化学平衡状态的是(填选项字母).
A.H2的消耗速率等于CH3OH的生成速率的2倍
B.H2的体积分数不再改变
C.H2的转化率和CO的转化率相等
D.混合气体的平均相对分子质量不再改变
(4)以甲醇为燃料,O2为氧化剂,KOH溶液为电解质溶液,可制成燃料电池(电极材料为惰性电极).若KOH溶液足量,写出燃料电池负极的电极反应式:
(5)如图所示,以甲醇燃料电池作为电源实现下列电解过程.乙池中发生反应的离子方程式为 . 当甲池中增重16g时,丙池中理论上产生沉淀质量的最大值为g. 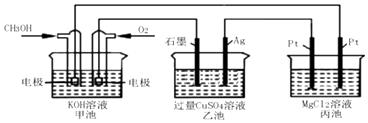
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某非金属X的最低负价为﹣m.它的最高价氧化物对应的水化物中有b个氧原子,则这种酸的分子式为( )
A.H2b﹣8+mXOb
B.H2b﹣m+8XOb
C.H2b﹣8﹣mXOb
D.H2b+8+mXOb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com