
2FeS + 6H2SO4(浓) = Fe2(SO4)3 + 2 S ↓ + 3SO2 ↑ + 6H2O ,下列说法正确的是( )
A. 反应中氧化产物为Fe2(SO4)3和SO2
B. 氧化剂和还原剂的物质的量之比为3:1
C. 反应中每产生32g沉淀转移电子的数目为2NA
D. 反应中被Fe还原的硫酸和被S还原的硫酸之比1:2
科目:高中化学 来源:浙江省台州市2017届高三2月选考科目教学质量评估测试化学试卷 题型:选择题
下列离子方程式正确的是
A. 氯气溶于水:Cl2+H2O 2H++ClO-+Cl-
2H++ClO-+Cl-
B. 亚硫酸钠溶液被空气中的氧气氧化:SO32-+O2=SO42-
C. 氢氧化铁溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
D. 碳酸氢铵溶液和足量的氢氧化钠溶液混合加热:NH4++HCO3-+2OH- NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
下列说法正确的是
A. HClO2 →ClO2+Cl2+H2O(未配平), 1 mol HClO2分解时转移电子的物质的量为1 mol
B. 标准状况下,14 g CO、C2H4混合气体与11.2 L N2所含有的分子数都是0.5NA
C. 与金属Cu常温下反应放出气体的溶液可以存在的离子有:Fe2+、Al3+、SO42-、K+
D. 在燃煤时加入适量石灰石,可减少SO2的排放,其中发生的反应为2CaCO3+O2+2SO22CaSO3+2CO2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省高二下学期基础训练(15)化学试卷(解析版) 题型:选择题
将氯化钠、氯化铝、氯化亚铁、氯化铁、氯化镁五种溶液,通过一步实验就能加以区别,并只用一种试剂,这种试剂是
A. KSCN B. BaCl2 C. NaOH D. HCl
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:填空题
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。现用该浓硫酸配制450mL 1mol/L的稀硫酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平。

请回答下列问题:
(1)配制稀硫酸时,上述仪器中不需要使用的有______(选填序号),还缺少的仪器有______(写仪器名称);
(2)经计算,配制上述稀硫酸时需要用量筒量取上述浓硫酸的体积为______mL(保留一位小数)。
(3)接下来的操作是将上述所取浓硫酸进行稀释,稀释的操作是________________、__________________。
(4)在溶液配制过程中,下列操作会引起所配置硫酸的浓度偏低的有_________(填序号)
A.用量筒量取浓硫酸读数时仰视刻度线;
B.转移稀释的硫酸溶液后未洗涤烧杯和玻璃棒;
C.浓硫酸稀释后未经冷却即转移到容量瓶中;
D.容量瓶未干燥就用来配置溶液;
E.定容后摇匀溶液,发现液面低于刻度线,再加入少量水使液面与刻度线相平;
F.定容时仰视刻度线。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
下列离子方程式或电离方程式的书写正确的是( )
A. NaHSO4熔融:NaHSO4 = Na++H++SO42-
B. Al(OH)3酸式电离:Al(OH)3 = 3OH—+Al3+
C. 向Na2CO3溶液中滴入少量稀盐酸:CO32-+2H+ = H2O+CO2↑
D. Ca(HCO3)2溶液与少量NaOH溶液反应:OH-+HCO +Ca2+ = CaCO3↓+H2O
+Ca2+ = CaCO3↓+H2O
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省西安市高一上学期期末考试化学试卷(解析版) 题型:选择题
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A. 28g N2所含有的原子数为NA
B. 标准状况下,22.4 L水中含有的水分子数为NA
C. 500 mL 1.0 mol/L碳酸钠溶液中所含Na+的数为0.5NA
D. 49g纯硫酸所含有的氧原子数与标况下22.4L CO2中所含有的氧原子数相等
查看答案和解析>>
科目:高中化学 来源:2017届河南省天一大联考高三阶段性测试(四)(b卷)理综化学试卷(解析版) 题型:简答题
碳及其化合物在人们的日常生活、工农业生产及科学研究中有着重要的作用。回答下列有关问题:
(1)煤炭是人们利用最为广泛的燃料,但因煤炭含硫而导致大气污染。对燃煤烟气中的SO2可采用碳酸钙浆液法吸收,即把燃煤烟气和空气同时鼓入到含CaCO3的浆液中,使SO2被吸收。①该反应生成石膏(CaSO4 •2H2O),化学方程式为____________________。
②标准状况下,某种烟气中SO2含量为2.1×10-3g •L-1,则反应中转移3 mol电子时,处理标
准状况下烟气的体积为___________L(保留两位有效数字)。
(2)工业炼铁的基本原理是:在高温下,焦炭燃烧生成的CO将铁矿石中铁的氧化物还原得到铁。
已知:
①Fe2O3(s)+3C(s,石墨)==2Fe(s)+3CO(g) △H= +489.0 kJ• mol-1;
②C(s,石墨)+CO2(g) ==2CO(g) △H= +172.5 kJ• mol-1。
则CO还原Fe2O3(s)的热化学方程式为_______________________。
(3)碳酸二甲酯(DMC)是一种无毒、环保性能优异、用途广泛的化工原料。一定温度时,在容积为1.0 L的恒容密闭容器中充入2.5molCH3OH(g)、适量CO2和5×10-3催化剂,容器中发生反应:2CH3OH(g) +CO2(g)  CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
CH3OCOOCH3(g) +H2O(g) △H= -15.5kJ• mol-1。甲醇转化数(TON)与反应时间的关系如图1所示:
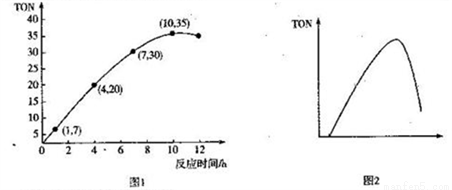
已知:TON=
①该温度时,甲醇的最高转化率为_______________。
② 0 ~7 h内DMC的平均反应速率是_______mol·L-1·h-1(保留两位有效数字)。
③图2是甲醇转化数随某种物理量的变化曲线,该物理量可能是_______;为使该反应向正
反应方向移动,可采取的措施有______________________。(答出一条即可)。
(4)CO2溶解于水形成碳酸。碳酸与次氯酸的电离常数如下表所示:
弱酸 | 碳酸 | 次氯酸 |
电离常数(Ka) | Ka1=4.4×l0-7 Ka2=5.6×10-11 | 3.0×10-8 |
在NaClO溶液中通入少量CO2 ,反应的离子方程式为_____________________,0.03 mol • L-1 NaClO 溶液的 pH=________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江苏省南京市高二学业水平模拟测试化学试卷(解析版) 题型:简答题
硫酸镁晶体(MgSO4·7H2O)是一种重要的化工原料,可用作制革、炸药、造纸、瓷器等。以菱镁矿(主要成分是碳酸镁,含少量FeCO3和不溶性杂质)为原料制取硫酸镁晶体的流程如下:
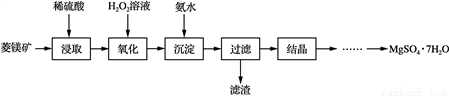
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Mg2+ | Fe2+ | Fe3+ |
开始沉淀 | 9.1 | 7.6 | 1.9 |
完全沉淀 | 11.1 | 9.7 | 3.2 |
(1) “氧化”步骤中,加入H2O2溶液的目的是________(用离子方程式表示)。“沉淀”步骤中,用氨水调节pH的范围是________。
(2) “过滤”所得滤液中含有的阳离子为Mg2+、________。
(3) “结晶”步骤中需蒸发浓缩滤液,使用的实验仪器有铁架台(含铁圈)、酒精灯、玻璃棒、____________________。
(4) 测定硫酸镁晶体样品中MgSO4·7H2O的含量常采用下列实验方法:
Ⅰ. 称取待测硫酸镁晶体样品1.500 g加入过量的EDTA,配成100 mL pH在9~10之间的溶液A。
Ⅱ. 移取25.00 mL溶液A于锥形瓶中,用0.1000 mol·L-1 Zn2+标准溶液与过量的EDTA反应,消耗Zn2+标准溶液20.00 mL。
Ⅲ. 另移取25.00 mL溶液A于另一只锥形瓶中,调节pH为5~6,用0.100 0 mol·L-1 Zn2+标准溶液与之充分反应,消耗Zn2+标准溶液35.00 mL。
已知:①pH为9~10时,Mg2+、Zn2+均能与EDTA(H2Y2-)反应:Mg2++H2Y2-===MgH2Y Zn2++H2Y2-===ZnH2Y
②pH为5~6时,Zn2+除与EDTA反应,还能与MgH2Y反应:Zn2++MgH2Y===ZnH2Y+Mg2+
③样品中杂质不参与反应。
计算硫酸镁晶体样品中MgSO4·7H2O的质量分数________。(写出计算过程)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com