
| A. | 同主族元素从上到下,元素原子得电子能力逐渐减弱,表现在氢化物的稳定性逐渐增强 | |
| B. | 除稀有气体元素外,第三周期元素的原子半径不一定比第二周期元素的原子半径大 | |
| C. | 化学反应的过程中一定伴随着热量的变化 | |
| D. | 在主族元素中,最外层电子数少的元素原于一定比最外层电子数多的元素原子失电子能力强 |
分析 A.同主族自上而下,元素非金属性减弱,氢化物稳定性减弱;
B.Li原子半径大于第三周期从Al开始向后的元素原子半径;
C.化学反应本质是旧键断裂、新键形成,一定伴随能量变化;
D.失去电子能力强弱与失去电子数目多少无关,与金属性有关.
解答 解:A.同主族自上而下,元素非金属性减弱,元素原子得电子能力逐渐减弱,氢化物稳定性减弱,故A错误;
B.Li原子半径大于第三周期从Al开始向后的元素原子半径,故B正确;
C.化学反应本质是旧键断裂、新键形成,一定伴随热量变化,故C正确;
D.失去电子能力强弱与失去电子数目多少无关,与金属性有关,如Ca失去电子能力比Na强,故D错误,
故选BC.
点评 本题考查元素周期律,难度不大,B为易错点,注意Cl原子半径在第二周期位置、Li原子半径在第三周期中位置.


 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
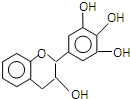 “茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )
“茶倍健”牙膏中含有茶多酚,但茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂.其中没食子儿茶素(EGC)的结构如图所示.关于EGC的下列叙述中正确的是( )| A. | 1 molEGC与足量溴水反应可消耗2 mol Br2 | |
| B. | EGC与苯酚属于同系物 | |
| C. | 在一定条件下,EGC中的羟基可被氯原子取代生成氯代烃 | |
| D. | 1mol EGC与含1.5mol Na2CO3的水溶液恰好完全反应生成1.5molCO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上生产玻璃、水泥、漂白粉及用铁矿石冶炼铁,均需要用石灰石为原料 | |
| B. | 未成熟的苹果肉遇碘酒变蓝色,成熟苹果的汁液能与银氨溶液发生反应 | |
| C. | 面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,过氧化苯甲酰属于有机物 | |
| D. | 大力实施矿物燃料“脱硫、脱硝技术”,可以减少硫的氧化物和氮的氧化物对环境的污染. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO42-、OH- |
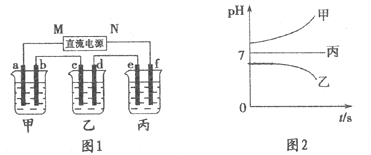
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=a的氨水溶液,稀释10倍后,其pH=b,则a=b+1 | |
| B. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(Cl-)=c(I-) | |
| C. | 0.1mol/LNH4Cl与0.1mol/L氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| D. | 含等物质的量的NaHC2O4和Na2C2O4的溶液:2c(Na+)=3[c(HC2O4-)+c(C2O42-)+c(H2C2O4)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
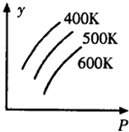
| A. | 平衡时,混合气体中R的百分含量 | B. | 平衡时,混合气中G的百分含量 | ||
| C. | G的转化率 | D. | L的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com