
【题目】单质Z是一种常见的半导体材料,可由X通过如下图所示的路线制备,其中X为Z的氧化物,Y为氢化物,分子结构与甲烷相似,回答下列问题:
![]()
(1)能与X发生化学反应的酸是_________;由X制备Mg2Z的化学方程式为_________。
(2)由Mg2Z生成Y的化学反应方程式为_________,Y分子的电子式为_________。
(3)Z、X中共价键的类型分别是_________。
【答案】氢氟酸 SiO2+Mg![]() O2↑+Mg2Si Mg2Si+4HCl=2MgCl2+SiH4
O2↑+Mg2Si Mg2Si+4HCl=2MgCl2+SiH4 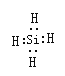 非极性键、极性键
非极性键、极性键
【解析】
单质Z是一种常见的半导体材料,则Z为Si,X为Z的氧化物,则X为SiO2,Y为氢化物,分子结构与甲烷相似,则Y为SiH4,加热SiH4分解得到Si与氢气。
(1)能与SiO2发生化学反应的酸是氢氟酸;由SiO2制备Mg2Si的化学方程式为:SiO2+4Mg![]() 2MgO+Mg2Si。
2MgO+Mg2Si。
(2)由Mg2Z生成Y的化学反应方程式为:Mg2Si+4HCl=2MgCl2+SiH4↑,Y为SiH4,电子式为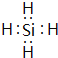 。
。
(3)Z为Si,周期表中位于第三周期IVA族,其单质属于原子晶体,化学键类型为非极性共价键;X为SiO2,属于原子晶体,含有的化学键属于极性共价键。


 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【题目】下列有关物质用途的描述不符合事实的是
A.铝制容器可以贮运稀硫酸
B.氧化铁可用作外墙涂料
C.碳酸氢钠可用作焙制糕点发酵剂
D.五彩缤纷的烟花是利用了某些金属化合物的焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:xA(g)+yB(g)![]() zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
zC(g)。平衡时测得A的浓度为0.50 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度降低为0.30 mol/L。下列有关判断错误的是 ( )
A. x+y<z B. 平衡向逆反应方向移动
C. B的转化率降低 D. C的体积分数下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可以利用废气中的CO2为原料制取甲醇,反应方程式为CO2+3H2![]() CH3OH + H2O,请回答下列问题:
CH3OH + H2O,请回答下列问题:
(1)已知常温常压下下列反应的能量变化如下图所示:

写出二氧化碳和氢气制备甲醇的热化学方程式_______________________________。
(2)如果只改变一个条件使上述反应的平衡常数K值变大,则该反应_____________。
A.一定向正反应方向移动 B.在平衡移动时正反应速率先增大后减小
C.一定向逆反应方向移动 D.在平衡移动时逆反应速率先减小后增大
(3)其他条件相同,该甲醇合成反应在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同的时间后,CO2的转化率随反应温度的变化如图所示:

①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是____________。
②c点CO2的转化率高于b点,原因是_________________________________。
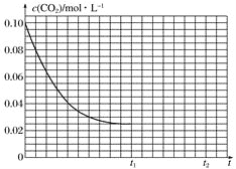
(4)常温常压下若反应的容器容积为2.0L,反应时间为4.0 min,容器里气体密度减少了2.0 g·,在这段时间内CO2平均反应速率为_____________。反应在t1时达到平衡,在这过程中c(CO2)随时间t变化的曲线如下图所示。保持其他条件不变,t1时将容器体积压缩到1 L,请在下图中画出t1后c(CO2)随时间t变化的趋势曲线(假设在t2时达到平衡)_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用下图所示装置对原电池和电解池原理进行实验探究。


请回答:
Ⅰ.用如图所示装置进行第一组实验。
(1)在保证电极反应不变的情况下,不能替代Cu作电极的是________(填序号)。
A.铝 B.石墨 C.银 D.铂
(2)N极发生反应的电极反应为________。
(3)实验过程中,SO42-________(填“从左向右”、“从右向左”或“不”)移动;滤纸上能观察到的现象有__________________。
Ⅱ.用图所示装置进行第二组实验。实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。
(4)电解过程中,X极区溶液的pH________(填“增大”、“减小”或“不变”)。
(5)电解过程中,Y极发生的电极反应为Fe-6e-+8OH-==Fe+4H2O和_____________。
(6)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应:2K2FeO4+3Zn===Fe2O3+ZnO+2K2ZnO2,该电池正极发生的反应的电极反应为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 碳酸钙与足量浓硝酸反应:CaCO3+2H+![]() Ca2++H2O+CO2↑
Ca2++H2O+CO2↑
B. 氢氧化钠溶液与稀醋酸反应:OH-+H+![]() H2O
H2O
C. 氯化铝溶液与过量氨水反应: A13++3OH-=A1(OH)3↓
D. 钠与水反应:Na+2H2O![]() Na++2OH-+H2↑
Na++2OH-+H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物的转化过程如下图所示。

下列分析合理的是( )
A. N2与H2反应生成NH3的原子利用率为100%
B. 催化剂a、b能提高反应的平衡转化率
C. 催化剂a表面发生了极性共价键的断裂和形成
D. 在催化剂b表面形成氮氧键时,不涉及电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F为中学化学常见的单质或化合物,其中A、F为单质,常温下,E的浓溶液能使铁、铝钝化,相互转化关系如图所示(条件已略去)。完成下列问题:
(1)若A为淡黄色固体,B为气体,F为非金属单质。
①写出E转变为C的化学方程式_____。
②B在空气中能使银器表面失去金属光泽、逐渐变黑,反应的化学方程式为_____。
(2)若B为能使湿润的红色石蕊试纸变蓝的气体。
①A的电子式为_____。
②做过银镜反应后的试管可用E的稀溶液清洗,反应的离子方程式为_____。
③在干燥状态下,向②反应得到的溶质中通入干燥的氯气,得到N2O5和一种气体单质,写出反应的化学方程式_____。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组研究在其他条件不变时,改变密闭容器中某一条件对A2(g)+3B2(g)![]() 2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )
2AB3(g) 化学平衡状态的影响,得到如下图所示的曲线(图中T表示温度,n表示物质的量)。下列判断正确的是( )

A. 在T2和n(A2)不变时达到平衡,AB3的物质的量大小 为:c>b>a
B. 若T2>T1,则正反应一定是放热反应
C. 达到平衡时A2的转化率大小为:b>a>c
D. 若T2>T1,达到平衡时b、d点的反应速率为vd>vb
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com