

| A. | a点时溶液的pH=7 | |
| B. | c点时的溶质是(NH3•H2O) | |
| C. | b点时溶液中c(NH4+)>c(NH3•H2O) | |
| D. | a~c段参与反应的离子有H+、OH-、Ba2+、SO42- |
分析 A.a点时,n(NH4HSO4)=2n[Ba(OH)2],该点溶液中发生的反应为2NH4HSO4+Ba(OH)2=BaSO4↓+(NH4)2SO4+2H2O,该点溶液中溶质为 (NH4)2SO4,(NH4)2SO4是强酸弱碱盐;
B.c点时,n(NH4HSO4)=n[Ba(OH)2],该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3.H2O+H2O,溶液中的溶质为NH3.H2O;
C.b点时,3n(NH4HSO4)=4n[Ba(OH)2],该点溶液中发生的反应为4NH4HSO4+3Ba(OH)2=3BaSO4↓+2NH3.H2O+(NH4)2SO4+4H2O,溶液中溶质为NH3.H2O、(NH4)2SO4,且二者的物质的量之比为2:1;
D.根据b、c点发生的反应确定反应的离子.
解答 解:A.a点时,n(NH4HSO4)=2n[Ba(OH)2],该点溶液中发生的反应为2NH4HSO4+Ba(OH)2=BaSO4↓+(NH4)2SO4+2H2O,该点溶液中溶质为 (NH4)2SO4,(NH4)2SO4是强酸弱碱盐,铵根离子水解导致溶液呈酸性,溶液的pH<7,故A错误;
B.c点时,n(NH4HSO4)=n[Ba(OH)2],该点溶液中发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3.H2O+H2O,溶液中的溶质为NH3.H2O,故B正确;
C.b点时,3n(NH4HSO4)=4n[Ba(OH)2],该点溶液中发生的反应为4NH4HSO4+3Ba(OH)2=3BaSO4↓+2NH3.H2O+(NH4)2SO4+4H2O,溶液中溶质为NH3.H2O、(NH4)2SO4,且二者的物质的量之比为2:1,因为一水合氨的电离程度大于铵根离子水解程度,导致b点时溶液中c(NH4+)>c(NH3•H2O),故C正确;
D.b点发生的反应为4NH4HSO4+3Ba(OH)2=3BaSO4↓+2NH3.H2O+(NH4)2SO4+4H2O、c点发生的反应为NH4HSO4+Ba(OH)2=BaSO4↓+NH3.H2O+H2O,所以a~c段参与反应的离子还有NH4+,故D错误;
故选BC.
点评 本题考查酸碱混合溶液定性判断,为高频考点,明确各点发生的反应及溶液中溶质成分是解本题关键,侧重考查学生分析判断能力,能正确书写各段反应方程式,题目难度中等.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:解答题
 =2Cr(OH)3↓+3O2↑+2H2O
=2Cr(OH)3↓+3O2↑+2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2气体通入NaOH溶液中,产生倒吸现象,说明SO2极易溶于水 | |
| B. | 将SO2通入BaCl2 溶液中至饱和,无沉淀产生,再通入Cl2,产生白色沉淀 | |
| C. | SO2气体通入溴水中,溴水的颜色褪去,说明SO2具有漂白性 | |
| D. | SO2气体通入Ba(NO3)2溶液中,溶液出现浑浊现象,说明有BaSO3沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解氯化镁溶液来制取镁 | |
| B. | 钠加入氯化镁的饱和溶液中可以制取金属镁 | |
| C. | 电解冶炼铝的原料是氯化铝 | |
| D. | 工业上用电解熔融氯化钠的方法制取钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳通入饱和碳酸钠溶液会有固体析出 | |
| B. | 用PH计测得某碱性溶液的pH为12.5 | |
| C. | 量取10.00ml水可以用滴定管或量筒 | |
| D. | 除去氯气中混有的氯化氢可通入饱和食盐水 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
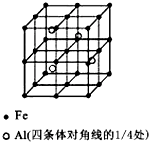 一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题:
一种Al-Fe合金的立体晶胞结构如图,请据此回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:
反应Fe+H2SO4═FeSO4+H2↑的能量变化趋势,如图所示:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com