
【题目】芳香族化合物A(C9H12O)常用于药物及香料的合成,A有如图转化关系:
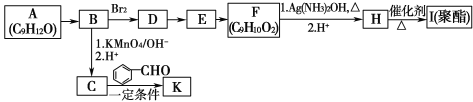
已知以下信息:
①A的苯环上只有一个支链,支链上只有两种不同化学环境的氢原子,且A能发生酯化反应;
②![]()
![]()
![]() +CO2;
+CO2;
③RCOCH3+R′CHO![]() RCOCH=CHR′+H2O。
RCOCH=CHR′+H2O。
回答下列问题:
(1)A生成B的反应类型为_______,由E生成F的反应方程式为_______。
(2)K中含有两个六元环,则K的结构简式为_________。
(3)由F生成H的过程中第1步的化学方程式为_________。
(4)H有多种同分异构体,满足下列条件的有________种,写出其中任意一种的结构简式:_________。
①能发生银镜反应 ②遇FeCl3溶液显紫色 ③具有4组核磁共振氢谱峰
【答案】消去反应 2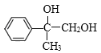 +O2
+O2![]() 2
2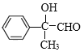 +2H2O
+2H2O ![]()
![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +2Ag↓+3NH3+H2O 4
+2Ag↓+3NH3+H2O 4 ![]() 或
或![]() 或
或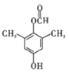 或
或
【解析】
A是芳香族化合物且苯环侧链上有两种处于不同环境下的氢原子,A的不饱和度=![]() =4,则侧链没有不饱和键,结合A分子式可知A结构为
=4,则侧链没有不饱和键,结合A分子式可知A结构为 ,B能与Br2发生加成反应,说明A发生消去反应生成B,B为
,B能与Br2发生加成反应,说明A发生消去反应生成B,B为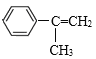 ,B和溴发生加成反应生成D为
,B和溴发生加成反应生成D为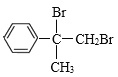 ,B发生氧化反应生成C,C能和苯甲醛发生信息③的反应,则C为
,B发生氧化反应生成C,C能和苯甲醛发生信息③的反应,则C为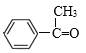 、K为
、K为![]() ;由F的分子式可知,D发生水解反应生成E为
;由F的分子式可知,D发生水解反应生成E为 ,E发生氧化反应生成F为
,E发生氧化反应生成F为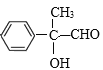 ,F发生银镜反应然后酸化得到H为
,F发生银镜反应然后酸化得到H为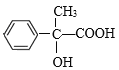 ,H发生缩聚反应生成I为
,H发生缩聚反应生成I为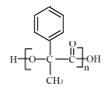 。
。
根据上述分析可知:A是 ;B是
;B是 ;C
;C ;D是
;D是 ;E是
;E是 ;F是
;F是 ;H是
;H是 ;I是
;I是 ;K是
;K是![]() 。
。
(1)A是 ;B是
;B是 ;A与浓硫酸共热发生消去反应生成B,所以A生成B的反应类型为消去反应;
;A与浓硫酸共热发生消去反应生成B,所以A生成B的反应类型为消去反应;
E是 ,E分子中由于羟基连接的C原子上有2个H原子,可以发生催化氧化产生F:
,E分子中由于羟基连接的C原子上有2个H原子,可以发生催化氧化产生F: ,所以由E生成F的反应方程式为:2
,所以由E生成F的反应方程式为:2 +O2
+O2![]() 2
2 +2H2O;
+2H2O;
(2)由上述分析可知K的结构简式为:![]() ;
;
(3)F是 ,含有醛基,能够与银氨溶液发生银镜反应,则由F生成H的过程中第1步的化学方程式为:
,含有醛基,能够与银氨溶液发生银镜反应,则由F生成H的过程中第1步的化学方程式为:![]() +2Ag(NH3)2OH
+2Ag(NH3)2OH![]()
![]() +2Ag↓+3NH3+H2O;
+2Ag↓+3NH3+H2O;
(4) H是 ,H的同分异构体满足条件:①能发生银镜反应,说明含有醛基;②遇FeCl3溶液显紫色,说明含有酚羟基;③具有4组核磁共振氢谱峰,说明分子中含有四种不同位置的H原子,则符合要求的同分异构体可能结构为:
,H的同分异构体满足条件:①能发生银镜反应,说明含有醛基;②遇FeCl3溶液显紫色,说明含有酚羟基;③具有4组核磁共振氢谱峰,说明分子中含有四种不同位置的H原子,则符合要求的同分异构体可能结构为:![]() 或
或![]() 或
或 或
或 ,共4种不同结构。
,共4种不同结构。


科目:高中化学 来源: 题型:
【题目】在![]() 时,某溶液中,
时,某溶液中,![]() 、
、![]() 、
、![]() 三者所占的物质的量分数
三者所占的物质的量分数![]() 随溶液pH变化关系如下图所示,下列叙述错误的是
随溶液pH变化关系如下图所示,下列叙述错误的是

A.![]() 是二元弱酸,其
是二元弱酸,其![]()
B.![]() 时,
时,![]() ,溶液中还存在
,溶液中还存在![]() 分子
分子
C.NaHR在溶液中![]() 电离程度大于水解程度
电离程度大于水解程度
D.将相同物质的量![]() 与NaHR固体完全溶于水可配得pH为
与NaHR固体完全溶于水可配得pH为![]() 的混合液
的混合液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素、钙元素、铜元素在化学中站有很重要的地位,单质及其化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔。请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为 ______。
② CaC2中C22-与O22+互为等电子体,1mol O22+中含有的![]() 键数目为 ______。
键数目为 ______。
③乙炔与氢氰酸反应可得丙烯睛(H2C=CH-C≡N),丙烯腈分子中碳原子轨道杂化类型是 ______,构成丙烯腈元素中第一电离能最大的是 ______。

(2)硼酸(H3BO3)是一种片层状结构的白色晶体,层内的H3BO3分子间通过氢健相连(如上图1)则1molH3BO3的晶体中有 ______ mol氢键。硼酸溶于水生成弱电解质一水合硼酸B(OH)3H2O,它电离生成少量[B(OH)4]-和H+,则[B(OH)4]-的空间构型为 ______。
(3)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如上图2所示(黑点代表铜原子,空心圆代表M原子)。
![]() 该晶体化学式为 ______。
该晶体化学式为 ______。
![]() 已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
已知铜和M的电负性分别为1.9和3.0,则铜与M形成的化合物属于 ______ (填“离子”、“共价”)化合物。
(4)Cu3N的晶胞结构如上图3,N3-的配位数为 ______ ,Cu+半径为apm,N3-半径为bpm,Cu3N的密度为 ______gcm-3(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学实验”已走进课堂,下列做法符合“绿色化学”的是
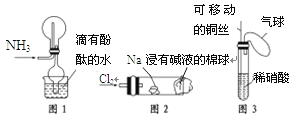
①实验室收集氨气采用图1所示装置
②实验室做氯气与钠的反应实验时采用图2所示装置
③实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸生成铵盐的实验
④实验室中采用图3所示装置进行铜与稀硝酸的反应
A. ②③④B. ①②③C. ①②④D. ①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以淀粉和油脂为原料,制备生活中某些物质。
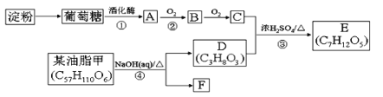
请回答下列问题:
(1)淀粉的分子式为____。
(2)③的反应类型___。
(3)写出反应①的化学方程式:____。写出反应④的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用硫铁矿焙烧去硫后的烧渣(主要成分为Fe2O3、FeO、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO47H2O),流程如图:
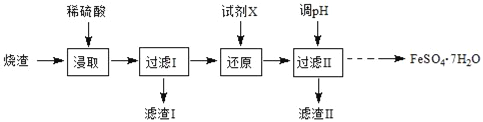
(1)滤渣Ⅰ的主要成分是_________(填化学式)。
(2)还原时,试剂X若选用SO2,则反应后的阴离子是_________(填化学式)。
(3)从分离出滤渣II后的滤液中得到产品,应进行的操作是_________、_________、过滤、洗涤、干燥。
(4)七水合硫酸亚铁(FeSO47H2O) 在医学上常用作补血剂。某课外小组通过以下实验方法测定某补血剂中亚铁离子的含量。
步骤a:取10片补血剂样品除去糖衣、研磨、溶解、过滤,将滤液配成250mL溶液;
步骤b:取上述溶液25mL于锥形瓶中,加入少量稀硫酸酸化后,逐渐滴加0.0100mol/L的KMnO4溶液,至恰好完全反应,记录消耗的KMnO4溶液的体积(假定药品中其他成分不与KMnO4反应),发生的反应为:MnO4﹣+5Fe2++8H+=5Fe3++Mn2++4H2O;
步骤c:重复“步骤b”2~3次,平均消耗KMnO4溶液20.00mL。
①步骤a中配制溶液时需要的玻璃仪器除烧杯、胶头滴管外,还需要_________、_________。
②该补血剂中亚铁离子的含量为_________mg/片。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为落实“五水共治”,某工厂拟综合处理含![]() 废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
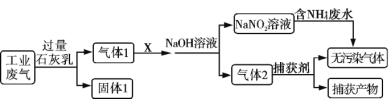
下列说法不正确的是
A.固体1中主要含有Ca(OH)2、CaCO3、CaSO3
B.X 可以是空气,且需过量
C.捕获剂所捕获的气体主要是CO
D.处理含![]() 废水时,发生反应的离子方程式为:
废水时,发生反应的离子方程式为:![]() +
+![]()
![]() N2↑+2H2O
N2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】刚结束的两会《政府工作报告》首次写入“推动充电、加氢等设施的建设”。如图是一种正负电极反应均涉及氢气的新型“全氢电池”,能量效率可达80%。下列说法中错误的是

A. 该装置将化学能转换为电能
B. 离子交换膜允许H+和OH-通过
C. 负极为A,其电极反应式是H2-2e- + 2OH- = 2H2O
D. 电池的总反应为H+ + OH-![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列叙述正确的是
A.1mol ICl与H2O完全反应生成氯化氢和次碘酸,转移的电子数为NA
B.常温常压下,56 g丁烯 (C4H8)中含有的共价单键总数为8 NA
C.电解精炼铜时,阳极质量减少64g,闭合回路转移的电子数一定为2NA
D.质量均为3.2g的S2、S4、S6中所含S原子数相等,都为0.1 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com