


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
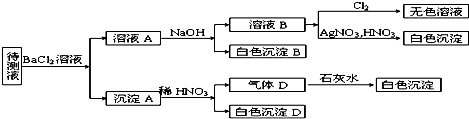
查看答案和解析>>
科目:高中化学 来源: 题型:
| 13 |
| 2 |
| 13 |
| 2 |
| 9 |
| 2 |
| 9 |
| 2 |
| A、2 878 kJ/mol |
| B、2 658 kJ/mol |
| C、1 746 kJ/mol |
| D、1 526 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、② | B、③ | C、①和④ | D、②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、都呈透明的红褐色 |
| B、都比较稳定,密封保存一段时间都不会产生沉淀 |
| C、分散质颗粒直径相同 |
| D、当有光线透过时,都能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据较强酸可以制取较弱酸的规律,推出CO2通入NaClO溶液中能生成HClO |
| B、根据同周期元素的非金属性变化趋势,推出O元素的非金属性比N元素弱 |
| C、根据主族元素最高正化合价与族序数的关系,推出氧族元素最高正价都是+6 |
| D、根据溶液的pH与溶液酸碱性的关系,推出pH=7的溶液一定显中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1molNaOH的质量为40g?mol-1 |
| B、标准状况下,1molH2O2的体积为22.4L |
| C、3.01×1023个SO2分子的质量为32g |
| D、CH4的摩尔质量为16g |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com