
| 实 验 用 品 | 溶 液 温 度 | 中和热△H ( kJ·mol-1) | ||||
| t1 | t2 | |||||
| | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.3℃ | | |
| ② | 50mL0.55mol·L-1NaOH | 50mL.0.5mol·L-1HCl | 20℃ | 23.5℃ | | |


 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:不详 题型:单选题
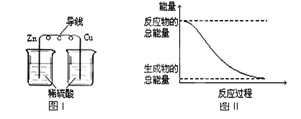
| A.化学反应中能量变化的主要原因是化学键的断裂与生成 |
| B.铝热反应中, 反应物的总能量比生成物的总能量低 |
| C.图I所示的装置能将化学能转变为电能 |
| D.图II所示的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.物质的燃烧一定是放热反应 |
| C.放热的化学反应不需要加热就能发生 |
| D.化学能与光能之间可以相互转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解水生成氢气和氧气时,电能主要转化为化学能 |
| B.白炽灯工作时,电能全部转化为光能 |
| C.煤燃烧时,化学能主要转化为热能 |
| D.风力发电时,风能主要转化为电能 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应物的总能量大于生成物的总能量 |
B.CH3COOH+KOH CH3COOK+H2O CH3COOK+H2O |
| C.破坏反应物全部化学键所需能量大于破坏生成物全部化学键所需能量 |
| D.C6H12O6(葡萄糖aq)+6O2→6CO2+6H2O |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是
2SO3(g) ΔH=-Q kJ·mol-1 (Q>0),下列说法正确的是 | A.相同条件下,2 mol SO2(g)和1 mol O2(g)所具有的能量小于2 mol SO3(g)所具有的能量 |
| B.将2 mol SO2(g)和1 mol O2(g)置于一密闭容器中充分反应后,放出热量为Q kJ |
| C.增大压强或升高温度,该平衡都向逆反应方向移动 |
| D.将一定量SO2(g)和O2(g)置于密闭容器中充分反应放热Q kJ此时有2 mol SO2(g)被氧化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如图⑶所示,现从t1时间开始对反应体系升高温度,n(C)的变化如图qb所示。则:
2C(g)在反应过程中C的物质的量n(C)随着时间变化关系如图⑶所示,现从t1时间开始对反应体系升高温度,n(C)的变化如图qb所示。则:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有能量变化的过程一定是化学变化过程 | B.需要加热才能发生的反应是吸热反应 |
| C.化学反应中一定伴有热量的变化 | D.物质发生燃烧的反应一定是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com