
| 编号 | 操作 | 现象 |
| Ⅰ |  | 反应剧烈,试管中的黑色固体逐渐溶解,产生大量的无色具有臭鸡蛋气味的气体. |
| Ⅱ | 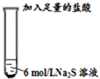 | 只有少量的无色臭鸡蛋气味的气体产生,但溶液中却有一定量的淡黄色沉淀产生. |
| 编号 | 操作 | 现象 |
| Ⅲ | 将H2S通入蒸馏水中达到饱和,将该溶液分为两等份.一份静置,另一份在空气中不断振荡. | 两份溶液在短时间内均未出现明显的浑浊现象. |
| 编号 | 操作 | 现象 |
| Ⅳ | 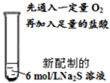 | 先通入一定量O2,几乎看不到明显变化;加入足量的盐酸,产生无色具有臭鸡蛋气味的气体,溶液中有大量的淡黄色沉淀产生. |
| ||
| ||


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
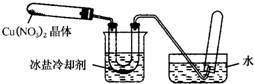 某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.
某化学探究小组拟用铜片制取Cu(NO3)2,并探究其化学性质.| 实验操作步骤 | 预期现象与结论 |
| 步骤1:观察样品 | 溶液呈蓝绿色, |
| 步骤2:取少量溶液,滴加酸性KMnO4溶液 | |
| 步骤3: | 若溶液变为红色,说明产物中含+3价的铁元素;若溶液颜色无明显变化,则说明产物中不含+3价的铁元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CuS 不溶于强酸,FeS 可溶于强酸 |
| B、CuS 比FeS的溶解度更小 |
| C、H2S液中电离出的S2-浓度相当大 |
| D、转化成CuS是放热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
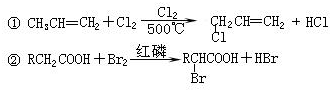
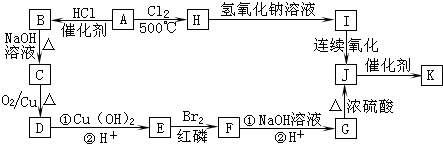
 ,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有
,又能发生银镜反应,遇FeCl3溶液又能呈紫色的同分异构体有查看答案和解析>>
科目:高中化学 来源: 题型:
| (三) | (一) | (五) | (二) | (六) | (四) |
 |  |  |  |  |  |
查看答案和解析>>
科目:高中化学 来源: 题型:
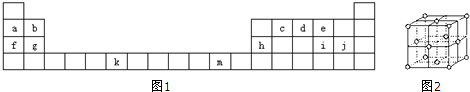
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、改变温度 |
| B、恒容,充入N2 |
| C、恒容,充入He气 |
| D、恒压,充入He气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com