
【题目】一定条件下,对于可逆反应:X(g)+3Y(g) ![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.08 mol ·L-1,则下列判断正确的是( )
A. c1∶c2=1∶3
B. 平衡时Y和Z的生成速率之比为2∶3
C. X、Y的转化率之比为1:3
D. c1的取值范围为0.04 mol·L-1<c1<0.14 mol·L-1
【答案】A
【解析】A.设X转化的浓度为x,
X(g)+3Y(g)2Z(g)
初始:c1 c2 c3
转化:x 3x 2x
平衡:0.1moL/L 0.3mol/L 0.08mol/L
所以c1:c2=(x+0.1moL/L):(3x+0.3mol/L)=1:3,故A正确;B.平衡时,正逆反应速率相等,则Y和Z的生成速率之比为3:2,故B错误;C.反应前后X、Y气体的浓度比相同符合反应系数之比,所以达到平衡状态时,转化率相同,故C错误;D.反应为可逆反应,物质不可能完全转化,如反应向逆反应分析进行,则c1>0,如反应向正反应分析进行,则c1<0.14molL-1,则:0<c1<0.14molL-1,故D错误;故答案为A。


科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 对于A(s)+B(g) ![]() C(g)+D(g)的反应,加入A,反应速率加快
C(g)+D(g)的反应,加入A,反应速率加快
B. 2NO2![]() N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
N2O4(正反应放热),升高温度,v(正)增大,v(逆)减小
C. 一定温度下,反应 N2(g)+3H2(g) ![]() 2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
2NH3(g)在密闭容器中进行,恒压,充入He不改变化学反应速率
D. 100 mL2 mol·L—1稀盐酸与锌反应时,加入少量硫酸铜固体,生成氢气的速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。现给出化学键的键能(见下表):

计算H2(g)+ Br2(g)===2HBr(g)的反应热 ( )
A. +103 kJ·mol-1 B. +679 kJ·mol-1
C. -103 kJ·mol-1 D. +183 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中华民族历史悠久,在浩瀚的历史文明中有许多关于化学的记载,下列说法不合理的是( )
选项 | 古代文献 | 记载内容 | 涉及原理 |
A | 《淮南万毕术》 | “曾青得铁则化为铜” | 活泼金属置换不活泼金属 |
B | 《鹤林玉露·一钱斩吏》 | “一日一钱,千日千钱,绳锯木断,水滴石穿” | 不涉及化学变化 |
C | 《天工开物》 | “凡火药,硫为纯阳,硝为纯阴” | 纯阴指化合价降低,利用硝酸钾的氧化性 |
D | 《肘后备急方》 | “青蒿一握,以水二升渍,绞取汁” | 利用物理方法提取青蒿素 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是( )
A. 56g聚乙烯分子中含碳碳双键的数目为2 NA
B. 核聚变如21H+31H―→42He+10n,由于有新微粒生成,该变化是化学变化
C. 铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
D. 1L0.5mlol·L-1Al2Fe(SO4)4溶液中阳离子数目小于1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,一个密闭容器,中间有一个可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左边充入空气,右边充入H2和O2的混合气体,隔板恰好处于容器中间位置,将H2、O2的混合气体点燃引爆,活塞先左弹,恢复至室温后,隔板停在如图位置。则原来H2、O2的物质的量之比可能为

①4:1 ② 2:1 ③1:1 ④2:3
A.①②B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化材料具有高硬度、高强度、高韧性、极高的耐磨性及耐化学腐蚀性等优良的物化性能。以锆英石(主要成分为 ZrSiO4,含有少量Al2O3、SiO2、Fe2O3等杂质)为原料通过碱熔法制备氧化锆(ZrO2)的流程如下:
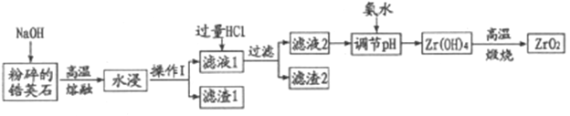
25℃时,有关离子在水溶液中沉淀时的pH数据:
Fe(OH)3 | Zr(OH)4 | Al(OH)3 | |
开始沉淀时pH | 1.9 | 2.2 | 3.4 |
沉淀完全时pH | 3.2 | 3.2 | 4.7 |
请回答下列问题:
(1)流程中旨在提高化学反应速率的措施有___________。
(2)操作I的名称是___________滤渣2的成分为___________。
(3)锆英石经“高温熔融”转化为Na2ZrO3,写出该反应的化学方程式:___________。
(4)“调节pH”时,合适的pH范围是___________。为了得到纯的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是___________。
(5)写出“高温煅烧”过程的化学方程式___________。根据ZrO2的性质,推测其两种用途___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1mol Cl-、ClOx- (x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
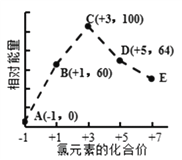
A. 这些离子中结合H+能力最强的是E
B. A、B、C、D、E五种微粒中C最稳定
C. C→B+D,反应物的总键能大于生成物的总键能
D. B→A+D反应的热化学方程式为:3ClO—(aq) == ClO3—(aq) + 2Cl—(aq) △H = -116kJmol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂制备净水剂硫酸铁铵晶体[NH4Fe(SO4)2·6H2O]的一种方案如下:

下列说法不正确的是
A. 滤渣A的主要成分是CaSO4
B. 相同条件下,NH4Fe(SO4)2·6H2O净水能力比FeCl3强
C. “合成”反应要控制温,温度过高,产率会降低
D. “系列操作”包括蒸发浓缩、降温结晶、过滤、干燥等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com