
【题目】物质氧化性、还原性的强弱,不仅与物质的结构有关,还与物质的浓度和反应温度有关。下列各组物质:①Cu和HNO3溶液 ②Cu和FeCl3溶液 ③Zn与H2SO4溶液 ④Fe和HCl溶液 由于浓度不同而能发生不同氧化还原反应的是
A. ③④B. ①③C. ①②D. ①③④
【答案】B
【解析】
①Cu与HNO3溶液反应时,若为浓硝酸,发生Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,若为稀硝酸,则发生3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O,与浓度有关,故选①;
②Cu与FeCl3溶液发生反应:Cu+2FeCl3═2FeCl2+CuCl2,与浓度无关,故不选②;
③Zn与H2SO4溶液反应时,若为稀硫酸,发生Zn+H2SO4═ZnSO4+H2↑,若为浓硫酸,则发生Zn+2H2SO4(浓)![]() ZnSO4+SO2↑+2H2O,与浓度有关,故选③;
ZnSO4+SO2↑+2H2O,与浓度有关,故选③;
④Fe与HCl溶液发生反应:Fe+2HCl=FeCl2+H2↑,与浓度无关,故不选④
答案:B


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】反应N2(g)+3H2(g)![]() 2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
2NH3(g) △H<0,若在恒压绝热的容器中发生,下列选项表明一定已达平衡状态的是
A. 容器内的温度不再变化
B. 容器内的压强不再变化
C. 相同时间内,断开H-H键的数目和生成N-H键的数目相等
D. 容器内气体的浓度c(N2):c(H2):c(NH3)=1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①O2 ②铝 ③Na2O ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨盐酸 ⑩CaCO3
(1)按物质的树状分类法填写表格的空白处:
_________ | 氧化物 | _________ | _________ | 电解质 | |
属于该类的物质 | ② | _________ | ⑧ ⑨ | ⑦ | _________ |
(2)写出实验室制备①的化学方程式:____________________。
(3)上述十种物质中,有两种物质之间可发生H++OH-=H2O,该离子反应对应的化学方程式为_________________。
(4)写出制备⑦的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或模型正确的是( )
A. CH4分子的比例模型:![]() B. 乙醇的结构简式:C2H6O
B. 乙醇的结构简式:C2H6O
C. Al3+的结构示意图:![]() D. 氯化钙的电离方程式:CaCl2===Ca2++Cl2-
D. 氯化钙的电离方程式:CaCl2===Ca2++Cl2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
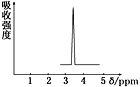
(1) 化合物A和B的分子式都是C2H4Br2,A的核磁共振谱图如图所示,则A的结构简式为____________________,请预测B的核磁共振谱上有______个峰(信号)
(2) 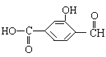 中含有的官能团的名称为_________、__________、__________。
中含有的官能团的名称为_________、__________、__________。
(3) 在戊烷的各种同分异构体中,核磁共振氢谱只有一个吸收峰的结构简式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法错误的是( )
A. 一定条件下,2molSO2和1molO2混合在密闭容器中,充分反应后容器中的分子数大于2NA
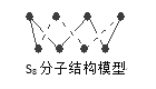
B. 256gS8分子(结构如图)中含S-S键为7NA个
C. 由1molCH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个
D. 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】己知M2On2-可与R2-作用,R2-被氧化为R单质,M2On2-的还原产物中M为+3价;又知c(M2On2-) =0.3mol/L的溶液100mL 可与c(R2-)=0.6mol/L的溶液150mL恰好完全反应,则n值为()
A.4 B.5 C.6 D.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯氧化法处理含CN-的废水过程中,液氯在碱性条件下可以将氰化物氧化成氰酸盐(其毒性仅为氰化物的千分之一),氰酸盐进一步被氧化为无毒物质。
(1)某厂废水中含KCN,其浓度为0.65mol / L。现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O,该反应中被氧化的元素是 __________(写元素符号),氧化产物为_____________(写化学式)。
(2)投入过量液氯,可将氰酸盐进一步氧化为氮气(2KOCN+4KOH+3Cl2=2CO2↑+N2↑+6KCl+2H2O)。若反应转移120mol电子,则消耗0.1mol / LKOH_________L 。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解不生成O2只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1,写出该反应的化学方程式_____________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com