
【题目】某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中( )
A.一定有SO42-
B.可能有SO42- 或Ag+
C.一定无Ag+
D.还可能有CO32-
 百年学典课时学练测系列答案
百年学典课时学练测系列答案 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案科目:高中化学 来源: 题型:
【题目】一种由菱镁矿(主要成分MgCO3、CaCO3、FeCO3、SiO2)制备高纯氢氧化镁的工艺如下:

(1)“煅烧”时FeCO3发生反应的方程式为_____。
(2)“浸取”温度100℃左右,该步骤含镁化合物参与反应的化学方程式为______。
(3)“浸取”时NH4Cl用量对Mg2+浸出率的影响曲线如右图所示。下列有关说法正确的____(填序号)。

A.“浸取”时适当搅拌浆料
B.用超理论用量20%的NH4Cl进行浸取
C.可用NH4Cl对浸取后的滤渣进行二次浸取,将两次浸取液合并
D.浸出温度采用100℃可促进NH4Cl的水解和NH3的逸出
(4)本工艺流程中可循环利用的物质有______。
(5)若要得到高纯Mg(OH)2,需对“沉镁”步骤所得的固体进行洗涤,检验固体已洗净的方法是_______。
(6)25℃时,Ksp(CaSO4)=7.2×10-5。实验测得“除钙”前后溶液中c(Ca2+)分别为2.8g/L和0.8g/L,则1L溶液至少需加入MgSO4固体的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向苯酚浊液中滴加Na2CO3溶液:2C6H5OH+CO32-=2C6H5O-+H2O+CO2↑
C. 向偏铝酸钠溶液中加入NaHCO3溶液: AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D. 碳酸氢铵溶液中加入足量NaOH溶液共热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是 ( )
A.丙烷与氯气在光照的作用下生成氯丙烷的反应
B.乙烯与水生成乙醇的反应
C.乙烯与溴的四氯化溶液生成溴乙烷的反应
D.乙烯自身生成聚乙烯的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温时通过以下反应制备金属铝。用铝制作的“快速放电铝离子二次电池”的原理如右图所示(EMI+为有机阳离子)。

①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH1=a kJ·mol-1
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH2=b kJ·mol-1
③Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3
下列说法正确的是( )
A. ΔH3<0
B. Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH3=(a-b) kJ·mol-1
C. 该电池充电时石墨电极与电源负极相连
D. 该电池放电时的负极反应方程式为Al-3e-+7AlCl===4Al2Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A是一种红棕色金属氧化物,B、D是常见的金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

(1)写出下列物质的化学式:A:_________I:_________J:_________G:_________;
(2)按要求写出下列反应的方程式
C→I的离子方程式:_____________________________________
F→G的化学方程式:_____________________________________
(3)将一定量A和C混合物溶于100mL稀硫酸中,向反应后的溶液中缓慢加入NaOH溶液,加入NaOH溶液的体积与生成沉淀的质量关系如图所示,试回答:

①混合物中含A的质量为______________;
②所用硫酸溶液物质的量浓度为___________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________nm.
(3)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是____________。
(4)我国早在春秋战国就开始生产和使用铁器,写出工业上用赤铁矿为原料炼铁的化学方程式:_______________________________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温下,在三个相同且恒容的容器中发生反应 2SO2(g)+O2(g)![]() 2SO3(g)△H=-196kJ/mol,有关数据如下:
2SO3(g)△H=-196kJ/mol,有关数据如下:
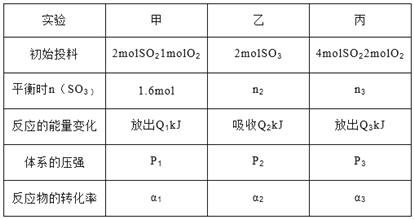
三个容器中反应分别达到平衡时下列数据关系正确的是( )
A. α1+α2= 1 且α3<α1 B. Q1+Q2=196 且 Q3>2Q1
C. n2<n3<3.2mol D. P3>2P1=2P2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com