
| V |
| Vm |
| m |
| M |
| 448×10-3L |
| 22.4L/mol |
| 2.64g |
| 44g/mol |
| 0.06mol |
| 0.02mol |
| 160g×2% |
| 160g/mol |


 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
| A、标准状况下,2.24L H2O含有的分子数等于0.1NA |
| B、1 mol Na2O2所含阴离子数为2NA |
| C、含有lmol Fe(OH)3的氢氧化铁胶体中胶粒个数为NA |
| D、在常温下,4.4g的CO2和N2O混合气体所含的原子数一定是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
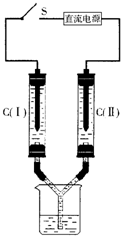 如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S后,C(Ⅱ)附近溶液变红,两玻璃管中有气体生成.下列说法正确的是( )
如图所示装置,两玻璃管中盛满滴有酚酞溶液的NaCl饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极.接通S后,C(Ⅱ)附近溶液变红,两玻璃管中有气体生成.下列说法正确的是( )| A、C(Ⅰ)电极产生可燃性气体 | ||||
| B、C(Ⅱ)的电极附近溶液呈碱性 | ||||
| C、C(Ⅱ) 电极产生的气体可使湿润的碘化钾淀粉试纸变蓝色 | ||||
D、电解过程中发生的化学方程式为:2NaCl
|
查看答案和解析>>
科目:高中化学 来源: 题型:
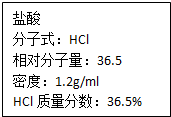 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
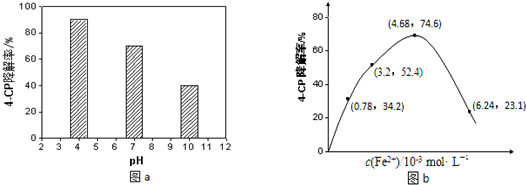
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com