
| 1000ρω |
| M |
| 1000×1.153×14% |
| 40 |
| 4.04mol |
| 1153g |


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:
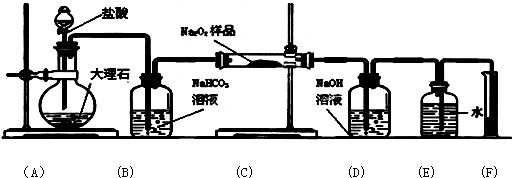
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10-6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钢管与电源正极连接,钢管可被保护 |
| B、铁遇冷浓硝酸表面钝化,可保护内部不被腐蚀 |
| C、钢管与铜管露天堆放在一起时,钢管不易被腐蚀 |
| D、钢铁发生析氢腐蚀时,负极反应是2H++2e-═H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
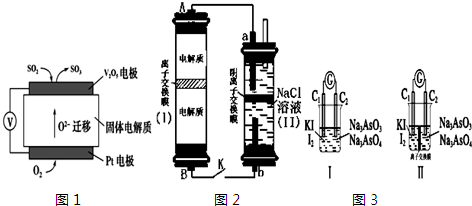
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、高温下,0.2molFe与足量稀硫酸反应反应,生成的H2分子数目为0.3NA |
| B、78g过氧化钠中含阴离子数为2 NA |
| C、C2H4和N2组成的42g混合气体中原子的个数为3 NA |
| D、5NH4 NO3═2HNO3+4N2↑+9H2O反应中,生成28gN2 时,转移的电子数目为3.75NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
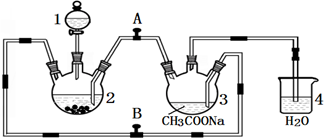
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com