
| ||
| ||
| 2.8g |
| 28g/mol |
| 4.4g |
| 44g/mol |
| 5.4g |
| 18g/mol |
| 0.1mol+0.1mol |
| 0.1mol |
| 0.3mol×2 |
| 0.1mol |
| 0.1mol×2+0.1mol+0.3mol-0.5mol |
| 0.1mol |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
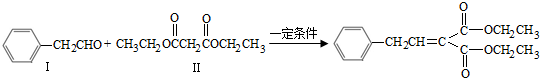
 可合成化合物I.化合物Ⅳ是
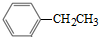
可合成化合物I.化合物Ⅳ是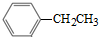 的同分异构体,Ⅳ的核磁共振氢谱有两族峰,峰面积之比为4:6,且在CrO-乙酐催化下反应生成能生成银镜反应的化合物V,Ⅳ的结构简式为
的同分异构体,Ⅳ的核磁共振氢谱有两族峰,峰面积之比为4:6,且在CrO-乙酐催化下反应生成能生成银镜反应的化合物V,Ⅳ的结构简式为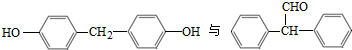 也可以发生类似反应①的反应,产物的结构式为
也可以发生类似反应①的反应,产物的结构式为查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
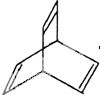 I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写
I.有机物的结构可用“键线式”简化表示.CH3-CH=CH-CH3可简写 为.有机物X的键线式如图:
为.有机物X的键线式如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
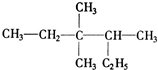 系统命名法命名为
系统命名法命名为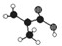 所示(图中球与球之间的连线代表化学键,如单键、双键等).
所示(图中球与球之间的连线代表化学键,如单键、双键等).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com