
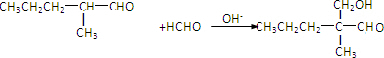 .
. .
.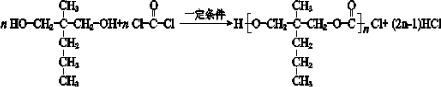 .
.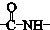 ”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是
”结构,P的核磁共振氢谱有5组峰,P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.则P的结构简式是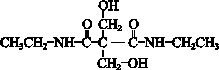 .
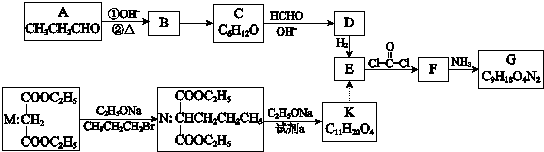
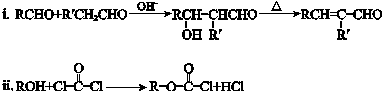
. 分析 由题给信息可知B为CH3CH2CH=C(CH3)CHO,分子式为C6H10O,则C的分子式为C6H12O,可知B发生加成反应生成C,A与C含有相同的官能团,则C为CH3CH2CH2CH(CH3)CHO,D应为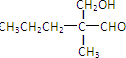 ,与氢气发生加成反应生成E为
,与氢气发生加成反应生成E为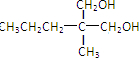 ,由信息ii可知F为
,由信息ii可知F为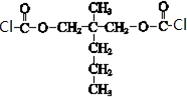 ,G为
,G为 ,N的分子式为C10H18O4,由M→N的信息可知K为
,N的分子式为C10H18O4,由M→N的信息可知K为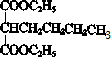 ,试剂a为CH3Br等,以此解答该题.
,试剂a为CH3Br等,以此解答该题.
解答 解:由题给信息可知B为CH3CH2CH=C(CH3)CHO,分子式为C6H10O,则C的分子式为C6H12O,可知B发生加成反应生成C,A与C含有相同的官能团,则C为CH3CH2CH2CH(CH3)CHO,D应为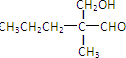 ,与氢气发生加成反应生成E为
,与氢气发生加成反应生成E为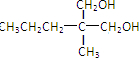 ,由信息ii可知F为
,由信息ii可知F为 ,G为
,G为 ,N的分子式为C10H18O4,由M→N的信息可知K为
,N的分子式为C10H18O4,由M→N的信息可知K为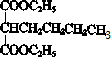 ,试剂a为CH3Br等,
,试剂a为CH3Br等,
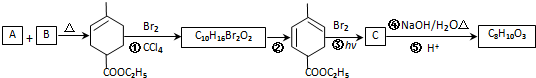
(1)A含有醛基,具有还原性,可用新制氢氧化铜(或银氨溶液)检验,故答案为:醛基;新制氢氧化铜(或银氨溶液);
(2)C为CH3CH2CH2CH(CH3)CHO,B为CH3CH2CH=C(CH3)CHO,可与氢气发生加成反应生成C,故答案为:加成反应;
(3)C生成D的化学方程式是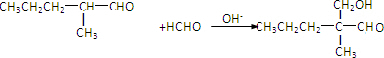 ,
,
故答案为: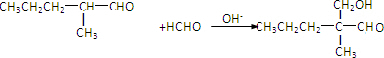 ;
;
(4)由以上分析可知试剂a为CH3Br,故答案为:CH3Br;
(5)a.E为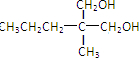 ,含有羟基,可发生取代反应、氧化反应,但不能发生消去反应,故a错误;
,含有羟基,可发生取代反应、氧化反应,但不能发生消去反应,故a错误;
b.K为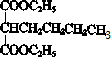 ,与M结构相似,分子式不同,则M与K是同系物,故b正确;
,与M结构相似,分子式不同,则M与K是同系物,故b正确;
c.1mol K含有2mol酯基,能跟2mol NaOH发生反应,故c正确;
故答案为:b、c;
(6)由以上分析可知G为 ,故答案为:
,故答案为: ;
;
(7)E为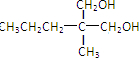 ,含有2个羟基,在一定条件下能跟COCl2发生聚合反应生成高分子化合物,该反应的化学方程式是
,含有2个羟基,在一定条件下能跟COCl2发生聚合反应生成高分子化合物,该反应的化学方程式是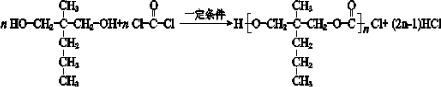 ,
,
故答案为: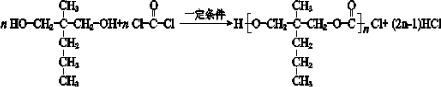 ;
;
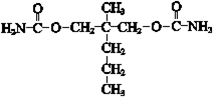
(8)G为 ,对应的同分异构体P,分子中含有“
,对应的同分异构体P,分子中含有“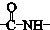 ”结构,P的核磁共振氢谱有5组峰,说明有5种H原子,
”结构,P的核磁共振氢谱有5组峰,说明有5种H原子,
P能水解生成CH3CH2NH2和甲,1mol甲跟足量钠反应生成2mol H2.说明甲含有2个羟基、2个羧基),则P的结构简式是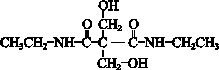 ,
,
故答案为: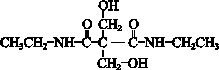 .
.
点评 本题考查有机物的推断及合成,为高考常见题型,同时考查学生知识迁移能力,利用题给信息进行分析解答,明确有机物的官能团及性质是解本题关键,难度较大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:5 | C. | 3:4 | D. | 5:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30.8% | B. | 28.6% | C. | 25.3% | D. | 22.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
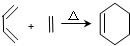 ,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2
,RCH2CH=CH2 $→_{nv}^{Br_{2}}$ RCHBrCH=CH2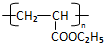 .
.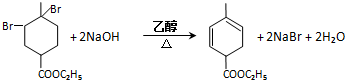 .
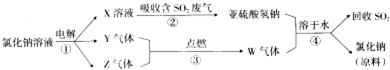
.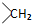 均2个,反应④的化学方程式为
均2个,反应④的化学方程式为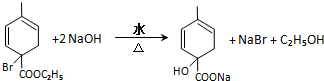 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 2mol•L-1 KCl溶液 | B. | 75mL 0.5mol•L-1CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 NaCl溶液 | D. | 75mL 1mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,16gO2中含有的氧分子数为NA | |
| B. | 1molOH-中含有的电子数为10NA | |
| C. | 标准状况下,11.2LH2O中含有的氢原子数为NA | |
| D. | 1mol/LBaCl2溶液中含有的钡离子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com