
【题目】氮化铝(室温下与水缓慢反应)是一种新型无机材料,广泛应用于集成电路生产领域。化学研究小组同学按下列流程制取氮化铝并测定所得产物中AlN的质量分数。
己知:AlN+NaOH+3H2O=Na[Al(OH)4]+NH3↑。
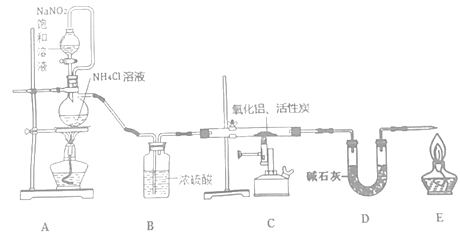
回答下列问题:
(1)检查装置气密性,加入药品,开始实验。最先点燃___(“A”、“C”或“E”)处的酒精灯或酒精喷灯。
(2)装置A中发生反应的离子方程式为___,装置C中主要反应的化学方程式为___,制得的AlN中可能含有氧化铝、活性炭外还可能含有___。
(3)实验中发现氮气的产生速率过快,严重影响尾气的处理。实验中应采取的措施是___(写出一种措施即可)。
(4)称取5.0g装置C中所得产物,加入NaOH溶液,测得生成氨气的体积为1.68 L(标准状况),则所得产物中AlN的质量分数为___。
(5)也可用铝粉与氮气在1000℃时反应制取AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,共主要原因是___。
【答案】A NH4++ NO2-![]() N2↑+2H2O Al2O3 +N2+3C
N2↑+2H2O Al2O3 +N2+3C ![]() 2AlN +3CO Al4C3 减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度 61.5% NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,便于Al快速反应
2AlN +3CO Al4C3 减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度 61.5% NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,便于Al快速反应
【解析】
⑴A装置制取氮气,浓硫酸干燥,氮气排除装置内的空气,反之Al反应时被空气氧化。
⑵根据氧化还原反应写出A、C的反应式,利用物质之间的反应推出C中可能出现的产物。
⑶从影响反应速率的因素思考减缓氮气生成速率。
⑷根据关系得出AlN的物质的量,计算产物中的质量分数。
⑸氯化铵在反应中易分解,生成的HCl在反应中破坏了Al表面的氧化膜,加速反应。
⑴A处是制取氮气的反应,可以排除装置内的空气,反之反应时Al被氧气氧化,因此最先点燃A处的酒精灯或酒精喷灯,故答案为:A。
⑵装置A是制取氮气的反应,A中发生反应的离子方程式为NH4++ NO2- ![]() N2↑+2H2O,装置C中主要反应的化学方程式为Al2O3 +N2+3C
N2↑+2H2O,装置C中主要反应的化学方程式为Al2O3 +N2+3C ![]() 2AlN +3CO,制得的AlN中可能含有氧化铝、活性炭外还可能是Al和C形成的化合物Al4C3,故答案为:NH4++ NO2-
2AlN +3CO,制得的AlN中可能含有氧化铝、活性炭外还可能是Al和C形成的化合物Al4C3,故答案为:NH4++ NO2- ![]() N2↑+2H2O;Al2O3 +N2+3C
N2↑+2H2O;Al2O3 +N2+3C ![]() 2AlN +3CO;Al4C3。
2AlN +3CO;Al4C3。
⑶实验中发现氮气的产生速率过快,严重影响尾气的处理,减缓氮气的生成速度采取的措施是减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度,故答案为:减缓亚硝酸钠的滴加速度或降低A处酒精灯加热的温度。
⑷生成氨气的体积为1.68 L即物质的量为0.075mol,根据方程式关系得出AlN的物质的量为0.075mol,则所得产物中AlN的质量分数为![]() ,故答案为:61.5%。
,故答案为:61.5%。
⑸在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,可能是NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,从而Al直接和氮气反应,因此其主要原因是NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,故答案为:NH4Cl受热分解生成氨气和氯化氢,氯化氢破坏了Al表面的氧化膜,便于Al快速反应。


科目:高中化学 来源: 题型:
【题目】800°C时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g) H<0,测得n(NO)随时间的变化如下表:
2NO2(g) H<0,测得n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.20 | 0.10 | 0.08 | 0.07 | 0.07 | 0.07 |
(1)NO的平衡浓度c(NO)=____________________。
(2)下图中表示NO2的变化的曲线______________。(填字母)
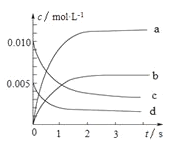
(3)能说明该反应已经达到化学平衡状态的是______________。
A.v(NO2)=2v(O2) B.容器内压强保持不变
C.v逆(NO)=v正(O2) D.容器内NO、O2、NO2同时存在
(4)下列操作中,能使该反应的反应速率增大,且平衡向正反应方向移动的是________。
A.及时分离出NO2气体B.适当升高温度
C.增大O2的浓度D.选择高效的催化剂
(5)下图中的曲线表示的是其它条件一定时,体系中NO的平衡转化率与温度的关系。图中标有a、b、c、d四点,其中表示v(正)<v(逆)的点是____________。(填选项)
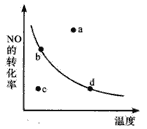
A.a B.b C.c D.d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在400℃时,将一定量的SO2和14molO2压入一个盛有催化剂的10L密闭容器中进行反应:2SO2+O2![]() 2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
2SO3,已知2min后,容器中剩余2molSO2和12molO2,则:
①生成了__molSO3,SO2的起始物质的量浓度是__。
②2min内平均反应速率:v(O2)=__。
(2)某温度时,在2 L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示。
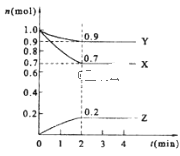
①X的转化率是__;
②由图中所给数据进行分析,该反应的化学方程式为___;
③若三种物质都是气体,则平衡时Y所占体积的百分比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) △H=-1025kJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
4NO(g)+6H2O(g) △H=-1025kJ/mol。若反应物起始物质的量相同,下列关于该反应的示意图不正确的是
A.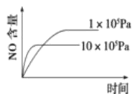 B.
B.
C.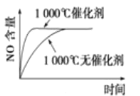 D.
D.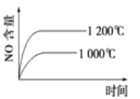
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁(FeC2O4)可作为生产电池正极材料磷酸铁锂的原料,受热容易分解,为探究草酸亚铁的热分解产物,按下面所示装置进行实验。
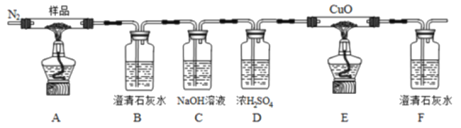
下列说法不正确的是
A.实验中观察到装置B、F中石灰水变浑浊,E中固体变为红色,则证明分解产物中有CO2和CO
B.反应结束后,取A中固体溶于稀硫酸,向其中滴加1~2滴KSCN溶液,溶液无颜色变化,证明分解产物中不含Fe2O3
C.装置C的作用是除去混合气中的CO2
D.反应结束后,应熄灭A,E处酒精灯后,持续通入N2直至温度恢复至室温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象与结论对应关系正确的是![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 常温下铜片插入浓硫酸中 | 无明显现象 | 常温下铜被浓硫酸钝化 |
B | 将 | 溶液红色褪去 |
|
C | 等体积 | HX放出的氢气多且反应速率快 | HX酸性比HY弱 |
D | 先向 | 开始有白色沉淀生成;后又有黑色沉淀生成 |
|
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关图示的说法正确的是

A. 图甲表示CH4 (g)+2O2 (g)=CO2 (g)+2H2O(1)的能量变化
B. 图乙表示压强对2A(g)+2B(g)![]() 3C(g)+D(g)的影响,且压强:P甲>P乙
3C(g)+D(g)的影响,且压强:P甲>P乙
C. 图丙表示温度对N2 (g)+3H2(g)![]() NH3 (g) △H<0的影响
NH3 (g) △H<0的影响
D. 图丁表示N2 (g)+3H2(g)![]() 2NH3 (g)平衡时NH3体积分数随起始n(N2)/n(H2)的变化,则转化率:αA(H2)=αB(H2)
2NH3 (g)平衡时NH3体积分数随起始n(N2)/n(H2)的变化,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对某难溶电解质AnBm的饱和溶液中,下列说法正确的是
A. 加同温度的水,其溶度积减小、溶解度增大
B. 升高温度,它的溶解度和溶度积都增大
C. 饱和溶液中c(Am+)=c(Bn﹣)
D. 加同温度的水,其溶度积、溶解度均不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学用如下装置电解食盐水,并对电解产物进行探究。
实验装置 | 电解质溶液 | 实验现象 | |
|
| a极附近 | b极附近 |
开始时,产生白色浑浊并逐渐增加,当沉入U形管底部时部分沉淀变为橙黄色;随后a极附近沉淀自下而上也变为橙黄色 | 产生无色气泡 | ||
资料显示:
①氯化亚铜(CuCl)为白色粉末,微溶于水;
②氢氧化亚铜(CuOH)为黄色不溶于水的固体,易脱水分解为红色的![]() ;
;
③![]() 水溶液中不稳定,酸性条件下易歧化为
水溶液中不稳定,酸性条件下易歧化为![]() 和Cu;
和Cu;
④氢氧化铜可以溶于浓NaOH得到蓝色溶液.
![]() 经检验,b极产生的气体是
经检验,b极产生的气体是![]() ,b极附近溶液的pH______
,b极附近溶液的pH______![]() 填“增大”、“减小”、或“不变”
填“增大”、“减小”、或“不变”![]() ;铜丝a应与电源的______
;铜丝a应与电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极相连。
极相连。
![]() 同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
同学们分析a极附近生成的白色浑浊是CuCl,则该极的电极反应式是______。
![]() ①橙黄色沉淀中含有
①橙黄色沉淀中含有![]() ,则CuCl转化为
,则CuCl转化为![]() 的原因是______
的原因是______![]() 用方程式表示
用方程式表示![]() ;
;
②结合离子在溶液中的运动规律,解释“
![]() 同学们通过实验进一步证实沉淀中含有
同学们通过实验进一步证实沉淀中含有![]() :将橙黄色沉淀滤出洗涤后,滴加
:将橙黄色沉淀滤出洗涤后,滴加![]()
![]() 至过量,应观察到的现象是______。
至过量,应观察到的现象是______。
![]() 同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为
同学们根据上述实验提出猜想:电解时,Cu做阳极先被氧化为![]() 。为此,他们用Cu电极电解
。为此,他们用Cu电极电解![]() NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
NaOH溶液,实验时观察到阳极产生大量无色气泡,附近溶液变蓝,未见预期的黄色沉淀。根据现象能否得出“该猜想不成立”的结论,并说明理由:______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com