
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出57.3 kJ的热量 |
分析 A、当反应物总能量>生成物总能量,则反应是放热反应;
B、物质的能量越低越稳定,形成化学键过程是放热过程;
C、燃烧热必须是1mol物质燃烧生成最稳定的氧合物所放出的能量;
D、中和热是强酸和强碱发生中和反应生成1mol水时,所放出的热量.
解答 解:A、当反应物总能量>生成物总能量,则反应是放热反应,△H<O,故A正确;
B、如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2.原子的能量比分子的能量高,所以原子灰结合成分子形成化学键放出热量,即2H=H2 放出热量,则2E1>E2,故B错误;
C、H2的燃烧热必须是1mol物质燃烧生成最稳定的氧合物液态水时所放出的能量,故C错误;
D、中和热是强酸和强碱的稀溶液发生中和反应生成1mol水时,所放出的热量,1molNaOH的氢氧化钠固体与含0.5molH2SO4的稀硫酸混合时,氢氧化钠固体溶于水放热,所以导致△H<-57.3kJ•mol-1,故D错误.
故选A.
点评 本题考查化学反应中的能量变化的有关知识,主要是反应的能量守恒的应用,形成化学键是放热反应,燃烧热、中和热的概念应用,可以根据所学知识进行回答,难度不大.


科目:高中化学 来源: 题型:填空题
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向Na2SiO3溶液中通入少量CO2:SiO32-+CO2+H2O═H2SiO3↓+CO32- | |
| C. | 铝粉投入NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | AlCl3溶液中加入足量氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
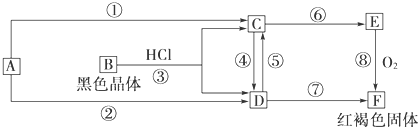
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不反应 | B. | 烧杯内溶液颜色逐渐变红 | ||
| C. | 金属钠沉入烧杯底部,并产生气泡 | D. | 金属钠浮于液面上,四处游动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
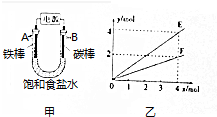
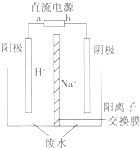
| A. | E表示反应生成NaOH的物质的量 | B. | E表示反应消耗H2O的物质的量 | ||
| C. | F表示反应生成H2或Cl2的物质的量 | D. | F表示反应消耗NaCl的物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶解度减小 | B. | 溶液中溶质的质量分数变小 | ||
| C. | 溶剂的质量减小 | D. | 溶液变成不饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 普通水泥 | B. | 普通玻璃 | C. | 汽车轮胎 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com