
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
分析 NaOH加入到AlCl3,所以先发生反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,直至AlCl3全部消耗完,然后再滴加NaOH有:Al(OH)3+NaOH=NaAlO2+2H2O
叠加上面的反应有:4NaOH+AlCl3=3NaCl+NaAlO2+2H2O,根据发生的反应结合碱的用量来计算.
解答 解:NaOH加入到AlCl3,所以先发生反应AlCl3+3NaOH=Al(OH)3↓+3NaCl,直至AlCl3全部消耗完,然后再滴加NaOH有:Al(OH)3+NaOH=NaAlO2+2H2O
叠加上面的反应有:4NaOH+AlCl3=3NaCl+NaAlO2+2H2O,
(1)当b≤3a时,生成氢氧化铝的物质的量为:100×b×10-3×$\frac{1}{3}$=$\frac{b}{30}$mol,质量是$\frac{b}{30}mol$×78g/mol=2.6bg;
(2)当a.b满足b≥4a时,无沉淀生成;
(3)当a.b满足当3a<b<4a时,沉淀量先最大,然后是逐渐溶解,此时得到沉淀的量是(0.4a-0.1b)mol,质量是(0.4a-0.1b)mol×78g/mol=(31.2a-7.8b)g;
故答案为:
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
点评 本题考查铝离子与碱的反应,明确碱的量的多少对反应的影响及发生的化学反应是解答本题的关键,难度不大.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
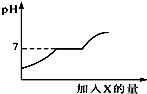 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的光合作用使得太阳能转化为化学能 | |
| B. | 人类使用照明设备是将电能转化为光能 | |
| C. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| D. | 燃料燃烧时只是将化学能转化为热能 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com