
【题目】分子式为C6H12O2的有机物A,有香味。A在酸性条件下水解生成有机物B和C。B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应,能催化氧化生成醛或酮。则A可能的结构有几种( )
A.4B.5C.6D.7
【答案】B
【解析】
分子式为![]() 的有机物A,有香味,A在酸性条件下水解生成有机物B和C,所以A是酯,且只含一个酯基;根据B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应,能催化氧化生成醛或酮,所以B是羧酸,C是醇;因为C不能发生消去反应生,能催化氧化生成醛或酮,则与羟基所连碳无邻位碳或相邻的碳上无氢原子,确定醇的结构,最后确定酯的结构。
的有机物A,有香味,A在酸性条件下水解生成有机物B和C,所以A是酯,且只含一个酯基;根据B能和碳酸氢钠溶液反应生成气体;C不能发生消去反应,能催化氧化生成醛或酮,所以B是羧酸,C是醇;因为C不能发生消去反应生,能催化氧化生成醛或酮,则与羟基所连碳无邻位碳或相邻的碳上无氢原子,确定醇的结构,最后确定酯的结构。
分情况
1、若B是甲酸,C为戊醇,符合条件只有1种:![]() ;
;
2、若B是乙酸,C为丁醇,没有符合条件的醇;
3、若B是丙酸,C为丙醇,没有符合条件的醇;
4、若B是丁酸,丁酸有2种,C为乙醇,没有符合条件的醇;
5、若B是戊酸,戊酸有4种,C为甲醇,符合条件;
所以A可能的结构有1+4=5种。
答案选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】![]() 下,弱电解质的电离平衡常数
下,弱电解质的电离平衡常数![]() ,下列说法正确的是
,下列说法正确的是
A.用![]() 的盐酸滴定
的盐酸滴定![]() 的氨水时,可用酚酞作指示剂
的氨水时,可用酚酞作指示剂
B.![]() 的醋酸与
的醋酸与![]() 的氢氧化钠溶液等体积混合,所得溶液中:
的氢氧化钠溶液等体积混合,所得溶液中:![]()
C.pH相同的![]() 、
、![]() 的两种溶液的
的两种溶液的![]() :
:![]()
D.![]() 的醋酸与
的醋酸与![]() 的氨水等体积混合,所得溶液中由水电离出的
的氨水等体积混合,所得溶液中由水电离出的![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究常温下难溶电解质的溶解平衡,查得如下资料:
难溶电解质 | FeS | CuS | Mg(OH)2 | Fe(OH)3 |
Ksp(溶解平衡常数) | 6.3×10-18 | 6.3×10-36 | 1.8×10-11 | 4.0×10-38 |
依据上述数据进行的预测不合理的是
A.向饱和FeS溶液中加入少量Na2S固体,有浑浊出现
B.除去FeSO4溶液中的CuSO4,可选用FeS做沉淀剂
C.向含等物质的量的MgCl2和FeCl3的混合溶液中逐滴加入NaOH溶液,最先出现的沉淀是Mg(OH)2
D.向1mL 0.1 mol·L—1MgCl2溶液中滴加2mL0.1mol·L—1 NaOH溶液,取澄清溶液滴加2滴0.1mol·L—1 FeCl3溶液,有浑浊出现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)可用于自来水消毒。以粗盐为原料生产ClO2的工艺主要包括:①粗盐精制;②电解微酸性NaCl溶液;③ClO2的制取。工艺流程如下图:
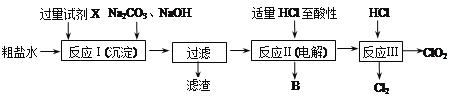
⑴ 粗食盐水中含有Ca2+、Mg2+、SO42-等杂质。除杂操作时,往粗盐水中先加入过量的试剂X,X是_____(填化学式),至沉淀不再产生后,再加入过量的Na2CO3和NaOH,充分反应后将沉淀一并滤去。经检测发现滤液中仍含有一定量的SO42-,其原因是_______。(已知:Ksp(BaSO4)=1.1×10-10;Ksp(BaCO3)=5.1×10-9)
⑵上述过程中,将食盐水在特定条件下电解得到的氯酸钠与盐酸反应生成ClO2。电解时生成的气体B是__;反应Ⅲ的化学方程式为________________。
⑶ ClO2很不稳定,需随用随制,产物用水吸收得到ClO2溶液。为测定所得溶液中ClO2的含量,进行了以下实验:
步骤1:准确量取ClO2溶液10.00 mL,稀释成100 mL试样。
步骤2:量取V1mL试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I-+H+—I2+Cl-+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。(已知:I2+2S2O32-=2I-+S4O62-)
① 准确量取10.00 mL ClO2溶液的玻璃仪器是_________________________。
② 滴定过程中,至少须平行测定两次的原因是________________________。
③ 根据上述步骤可计算出原ClO2溶液的物质的量浓度为__________mol·L-1(用含字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10 mL0.1 mol/L的HR溶液中逐滴加入0.1 mol/L的氨水,所得溶液pH及导电能力变化如图。下列分析正确的是( )
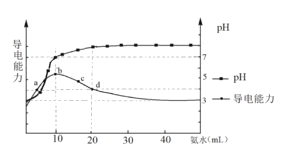
A. 各点溶液中的离子浓度总和大小关系:d>c > b > a
B. 常温下,R-的水解平衡常数数量级为10 -9
C. a点和b点溶液中,水的电离程度相等
D. d点的溶液中,微粒浓度关系:c(R-)+2c(HR)=c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮是一种重要的化工原料,实验室常用下列方法制备环己酮:
![]()
环己醇、环己酮和水的部分物理性质见下表:
物质 | 沸点(℃) | 密度(g·cm-3,20℃) | 溶解性 |
环己醇 | 161.1(97.8)★ | 0.9624 | 能溶于水 |
环己酮 | 155.6(95)★ | 0.9478 | 微溶于水 |
水 | 100.0 | 0.9982 |
★括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点
(1)酸性Na2Cr2O7溶液氧化环己醇反应的△H<0,反应剧烈将导致体系温度迅速上升,副反应增多。实验中将酸性Na2Cr2O7溶液加到盛有环己醇的烧杯中,在55~60℃进行反应。
反应完成后,加入适量水,蒸馏,收集95~100℃的馏分,得到主要含环己酮和水的混合物。
①酸性Na2Cr2O7溶液的加料方式为_______________。
②蒸馏不能分离环己酮和水的原因是_______________。
(2)环己酮的提纯需要经过以下一系列的操作:
a. 蒸馏,收集151~156℃的馏分; b. 过滤;
c. 在收集到的馏分中加NaCl 固体至饱和,静置,分液;
d. 加入无水MgSO4固体,除去有机物中的少量水。
①上述操作的正确顺序是________(填字母)。
②上述操作b、c中使用的玻璃仪器除烧杯、锥形瓶、玻璃棒外,还需__________。
③在上述操作c中,加入NaCl 固体的作用是____________。
(3)利用核磁共振氢谱可以鉴定制备的产物是否为环己酮,环己酮分子中有___种不同化学环境的氢原子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下CuS的溶度积常数为4.0×10-36,现将0.1 mol CuSO4放入100 mL 1.0 mol·L-1Na2S溶液中,充分搅拌反应(不考虑溶液体积变化),则下列说法不正确的是( )
A.反应后溶液的pH比反应前溶液的pH小
B.反应后溶液中不存在Cu2+、S2-
C.反应后溶液中c(Cu2+)与c(S2-)都约为2.0×10-16mol·L-1
D.若向饱和CuS水溶液中加入Na2S溶液,Ksp(CuS)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:
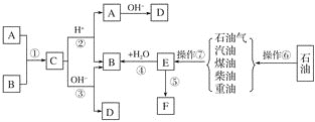
(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A 汽油 B 煤油
C 柴油 D 重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:___________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
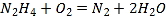
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com