

分析 高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,固体Ⅲ存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,过滤得到的溶液中含有偏铝酸钠、过量的氢氧化钠,在溶液中通入过量二氧化碳生成氢氧化铝沉淀,过滤得到沉淀为氢氧化铝,据此答题.
(1)石墨化学性质在常温下稳定,而在高温下可与氧气发生反应,所以通入氮气排尽装置中的空气,防止石墨发生氧化反应;
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠;
(3)金属氯化物的沸点均高于150℃,则固体Ⅲ中存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,过滤得到的溶液中含有偏铝酸钠、过量的氢氧化钠;
(4)偏铝酸钠发生水解,加入乙酸乙酯除去过量的氢氧化钠,且加热条件下水解平衡一直正向移动,得到氢氧化铝沉淀、醋酸钠、乙醇;
根据氧化铝的含量计算氧化铝质量,再根据Al元素守恒计算氢氧化铝的质量;
(5)工业上电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答该题.
解答 解:(1)石墨化学性质在常温下稳定,而在高温下可与氧气发生反应,所以通入氮气排尽装置中的空气,防止石墨发生氧化反应,减少石墨损失,
故答案为:排除装置中的空气;
(2)石墨过量高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,化学反应方程式为:SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O,
故答案为:CO;SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(3)金属氯化物的沸点均高于150℃,则固体Ⅲ中存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,搅拌、过滤得到溶液IV,故溶液IV中的阴离子有:AlO2-、OH-、Cl-,
故答案为:过滤;AlO2-、OH-、Cl-;
(4)偏铝酸钠发生水解,加入乙酸乙酯除去过量的氢氧化钠,且加热条件下水解平衡一直正向移动,得到氢氧化铝沉淀、醋酸钠、乙醇,由溶液IV生成沉淀V的总反应的离子方程式为AlO2-+CH3COOCH2CH3+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CH3COO-+CH3CH2OH+Al(OH)3↓,
Al2O3的质量分数为5.1%,则100kg初级石墨中氧化铝的质量=100kg×5.1%=5.1kg,根据Al元素守恒,可知氢氧化铝的质量为 $\frac{5.1kg×\frac{54}{102}}{\frac{27}{78}}$=7.8kg,
故答案为:AlO2-+CH3COOCH2CH3+2H2O $\frac{\underline{\;\;△\;\;}}{\;}$CH3COO-+CH3CH2OH+Al(OH)3↓;7.8.
(5)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,
故答案为:NO+5e-+6H+═NH4++H2O;氨气或氨水,根据反应8NO+7H2O$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3,电解产生的HNO3多.
点评 本题考查混合物分离提纯的综合应用,为高频考点,把握物质的性质、流程中的反应及混合物分离方法为解答的关键,侧重分析与实验能力的考查,题目难度不大.


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定大于92.4 kJ | B. | 一定小于92.4 kJ | C. | 一定等于92.4 kJ | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8 g | B. | 2.4g | C. | 3.6g | D. | 4.8g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稳定性:CH4>NH3>H2O>HF | B. | 熔沸点:CaO>BaO>NaCl>KCl | ||
| C. | 熔沸点:Na>Mg>Al | D. | 熔沸点:HF<HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间生成a mol X,同时生成3 a mol Y | |
| B. | Z的生成速率与Z的分解速率相等 | |
| C. | X、Y、Z的浓度相等 | |
| D. | X、Y、Z的分子个数比为1:3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
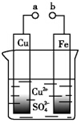
| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Cu2++2e Cu Cu | |
| C. | a和b用导线连接时,Fe为负极,Cu为正极,化学能转化为电能 | |
| D. | 无论a和b是否连接,铁片均会溶解,溶液均从蓝色逐渐变成浅绿色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙醇(水):加足量金属钠后,再蒸馏 | |
| B. | NaHCO3溶液(少量Na2CO3):通入足量的CO2气体 | |
| C. | 苯(混有Br2):加NaOH溶液洗涤、静置、分液 | |
| D. | FeCl3溶液(FeCl2):通入适量氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③ | C. | ①③ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷分子的球棍模型: | |
| B. | HClO的结构式:H-Cl-O | |
| C. | 质子数为53,中子数为78的碘原子:${\;}_{53}^{131}$I | |
| D. | 熔融状态下硫酸氢钾的电离方程式:KHSO4$\frac{\underline{\;熔融\;}}{\;}$ K++H++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com