
分析 燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C元素要转化为二氧化碳,H元素要转化为液态水,已知H2和CH2OCH3的燃烧热分别为285.8kJ/mol和1455.0kJ/mol,且H2O(l)=H2O(g)△H=+44.0kJ/mol,分别写出热化学方程式,然后根据盖斯定律,由已知热化学方程式乘以适当的系数进行加减,反应热也处于相应的系数进行相应的加减,构造目标热化学方程式.
解答 解:燃烧热是在101KP时,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,C元素要转化为二氧化碳,H元素要转化为液态水.
已知H2和CH2OCH3的燃烧热分别为285.8kJ/mol和1455.0kJ/mol,且H2O(l)=H2O(g)△H=+44.0kJ/mol,分别写出热化学方程式:
H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-285.8kJ/mol,
CH3OCH3(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1455.0kJ/molⅡ,
H2O(l)=H2O(g)△H=+44.0kJ/molⅢ,I×6-Ⅱ+3×Ⅲ,得到CO2和H2反应生成二甲醚和水蒸气的热化学方程式6H2(g)+2CO2(g)=CH3OCH3(l)+3H2O(g)△H=-127.8KJ/mol,
故答案为:6H2(g)+2CO2(g)=CH3OCH3(l)+3H2O(g)△H=-127.8kJ/mol.
点评 本题考查燃烧热的热化学方程式的书写,题目难度较大,注意表示热化学方程式的书写要注明物质聚集状态和反应热的正负号问题.


科目:高中化学 来源: 题型:解答题
 硫酸被称为是化学工业的发动机,硫酸的年产量可以作为衡量一个国家无机化学工业发展水平的标志,为提高经济效益,人类生产活动尽可能多功能化,共生工程将会大大促进化学工业的发展.
硫酸被称为是化学工业的发动机,硫酸的年产量可以作为衡量一个国家无机化学工业发展水平的标志,为提高经济效益,人类生产活动尽可能多功能化,共生工程将会大大促进化学工业的发展.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:
A、B、C、D均为中学化学常见的纯净物,A是单质.它们之间有如下的反应关系:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ,由D生成E的反应类型是消去反应.
,由D生成E的反应类型是消去反应. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 称取5.1 g Na2CO3,加入500 mL水 | |
| B. | 称取13.7 g Na2CO3•10H2O,配成500 mL溶液 | |
| C. | 称取5.3 Na2CO3,加入500 mL水 | |
| D. | 称取14.3 g Na2CO3•10H2O,配成500 mL溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
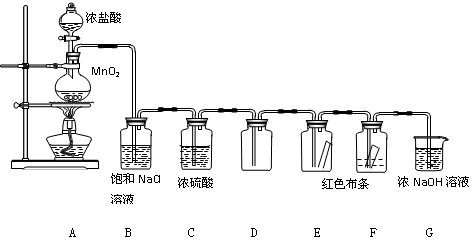
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com