
| A. | K2$\stackrel{+6}{Mn}$O4 | B. | Na2$\stackrel{+4}{S}$O3 | C. | H$\stackrel{+5}{C}$O3- | D. | $\stackrel{-3}{N}$H4+ |
科目:高中化学 来源: 题型:选择题
| A | 乙烷(乙烯) | 溴水 | 分液 |
| B | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
| C | 乙醇(少量水) | CaO | 蒸馏 |
| D | 乙醇(苯酚) | 适量的溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH小于5.6的降雨称为酸雨 | |
| B. | 充分利用太阳能有助于“节能减排” | |
| C. | 在燃煤中加入适量石灰石,有助于环境保护 | |
| D. | 含磷洗涤剂易被细菌分解,不会导致水体污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
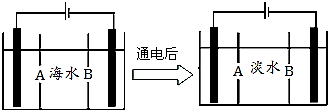 南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.
南海某小岛上,可利用的淡水资源相当匮乏,解放军战士为了寻找合适的饮用水源,对岛上山泉水进行分析化验,结果显示山泉水属于硬水.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
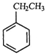 (g)+CO2(g)?
(g)+CO2(g)?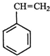 (g)+CO(g)+H2O(g)
(g)+CO(g)+H2O(g)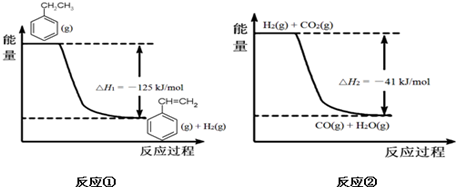
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$ ,该聚合物的链节为
,该聚合物的链节为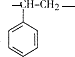 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
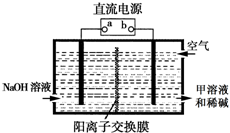 X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大.X元素一种原子核无中子.Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 失电子越多,还原性就一定越强 | |
| B. | 某元素由单质变为化合物,该元素有可能被氧化也有可能被还原 | |
| C. | 某物质焰色反应呈黄色,该物质一定含钠单质,可能含钾单质 | |
| D. | 金属氧化物一定是碱性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
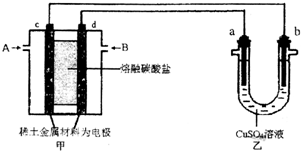
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com