
| A. | 原子半径:X<Y<W<Z | |
| B. | 由 W与Y组成的分子都是非极性分子 | |
| C. | 由 Z与Y组成的化合物都能与水反应 | |
| D. | X与氢元素组成的化合物的沸点都低于Y与氢元素组成的化合物 |
分析 X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,L为最外层电子数为4,故X是C元素;Z是短周期中金属性最强的元素,则Z为Na,X、W的质子数之和是Z的质子数的2倍,则6+W=2×11,可知W的质子数为16,即W为S,Y、W同主族,则Y为O,然后结合元素周期律及元素化合物知识来解答.
解答 解:X元素的原子,其最外层电子数是次外层的电子数的2倍,最外层电子数不能超过8个,则其次外层是K层,L为最外层电子数为4,故X是C元素;Z是短周期中金属性最强的元素,则Z为Na,X、W的质子数之和是Z的质子数的2倍,则6+W=2×11,可知W的质子数为16,即W为S,Y、W同主族,则Y为O,
A.电子层越多,原子半径越大,同周期原子序数大的原子半径小,则原子半径:Y<X<W<Z,故A错误;
B.W与Y组成的分子为二氧化硫或三氧化硫,二氧化硫为极性分子,故B错误;
C.Z与Y组成的化合物为氧化钠或过氧化钠,均与水反应,故C正确;
D.X与氢元素组成的化合物为烃,Y与氢元素水中含氢键,但烃未知,不能比较沸点,故D错误;
故选C.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、原子结构推断元素为解答该题的关键,侧重分析与推断能力的考查,注意元素周期律及元素化合物知识的应用,题目难度不大.


 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:选择题
| A. | “两水”都能与FeCl2溶液反应 | |
| B. | “两水”中都存在可逆反应 | |
| C. | “两水”都有刺激性气味 | |
| D. | “两水”都是混合物,溶液中含有的粒子种类数相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 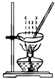 所示装置,蒸干NH4Cl饱和溶液制备NH4Cl晶体 | |
| B. | 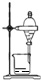 所示装置,分离CCl4萃取I2水后的有机层 | |
| C. | 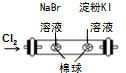 所示装置,证明氧化性:Cl2>Br2>I2 | |
| D. | 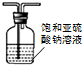 所示装置,除去SO2中混有的少量HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 加热盛有NH4Cl固体的试管,试管底部固体消失,试管口有晶体凝结. | NH4Cl固体可以升华 |
| B | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液,均有白色固体析出 | 蛋白质均发生变性 |
| C | 向NaBr溶液中滴入少量氯水和苯,振荡、静置,溶液上层呈橙红色. | Br-还原性强于Cl- |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不再有白色沉淀产生,再滴加0.1mol•L-1FeCl3溶液,白色沉淀变为红褐色沉淀 | 在水中的溶解度 Mg(OH)2<Fe(OH)3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 容量瓶、量筒和滴定管上都标有使用温度,容量瓶无“0”刻度,量筒、滴定管有“0”刻度;使用时滴定管水洗后还需润洗,但容量瓶水洗后不用润洗 | |
| B. | 向3支试管中各加入2mL 0.1mol•L-1酸性高锰酸钾溶液和2mL 0.01mol•L-1 H2C2O4溶液,将它们分别置于冰水、室温下、80℃热水中,观察比较褪色快慢 | |
| C. | 皂化反应结束后的混合液中加入饱和食盐水,再通过分液操作分离出硬脂酸钠 | |
| D. | 为保证实验安全,金属钠切割下来的表层物质应放回原试剂瓶,不能在研钵中研磨氯酸钾或硝酸钾 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中植物通过光合作用将太阳能转化为生物质能,而农村沼气池的建造、农作物制乙醇,都是有效的利用生物质能 | |
| B. | 纳米TiO2光触媒技术制成的“木地板精油”能将水气转化为活性氧,可以有效降解甲醛、苯、氨等居室污染物 | |
| C. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强酸、强碱都会“断路” | |
| D. | 同位素在医学显像、诊断和治疗,以及在改进农产品质量、增加产量等技术方面应用广泛 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若反应①中生成3.36 L氢气,则一定有2.7 g铝生成 | |
| B. | 氢化锂也是一种储氢材料,供氢原理为LiH+H2O═LiOH+H2↑ | |
| C. | 生成等质量的氢气,反应①、②转移电子数之比为4:3 | |
| D. | LiAlH4是共价化合物,LiH是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
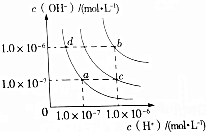
| A. | a点对应温度条件下,将pH=x的氨水稀释10倍后,其pH=y,则x=y+1 | |
| B. | 纯水仅升高温度,可从d点变到b点 | |
| C. | c点对应温度条件下醋酸的电离常数比a点对应温度条件下醋酸的电离常数大 | |
| D. | b点对应温度条件下,0.5mol•L-1的H2SO4溶液与1mol•L-1的KOH溶液等体积混合,充分反应后,所得溶液的c(H+)=10-7mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com