
| A. | 3.0g乙酸与甲酸甲酯的混合物中含有氧原子数目为0.2NA | |
| B. | 苯与液溴反应生成1mol溴苯分子,消耗0.5NA个Br2 | |
| C. | 常温常压下,等质量的N2H4和CH3OH含有相同数目的原子 | |
| D. | 6gSiO2晶体中含有0.4NA个Si-O键 |
分析 A.乙酸和甲酸甲酯的摩尔质量均为60g/mol,每个分子含有2个氧原子,带入N=$\frac{m}{M}{×N}_{A}$计算分子数;
B.苯与液溴1:1发生反应取代生成溴苯分子;
C.N2H4和CH3OH的摩尔质量相等,每个分子含有的原子数相同;
D.依据n=$\frac{m}{M}$计算物质的量,结合二氧化硅中每个Si形成4个Si一0键分析.
解答 解:A.3.0g乙酸与甲酸甲酯的混合物含有的分子数N=$\frac{m}{M}{×N}_{A}$=$\frac{3.0g}{60g/mol}$×${N}_{A}mo{l}^{-1}$=0.05NA,每个分子含有2个氧原子,因此含有的氧原子个数为0.1NA,故A错误;
B.苯与液溴反应取代生成1mol溴苯分子,消耗1molBr2,即为NA个Br2,故B错误;
C.由N=$\frac{m}{M}{×N}_{A}$可知,等质量的等质量的N2H4和CH3OH含有相同的分子数,又每个分子含有的原子数相同,因此含有相同的原子数,故C正确;
D.n=$\frac{6g}{60g/mol}$=0.1mol,二氧化硅中每个Si形成4个Si一0键,因此含有0.2NA个Si-O键,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,为高频考点,熟练掌握公式的使用和物质的结构是解题关键,题目难度中等.


科目:高中化学 来源: 题型:多选题
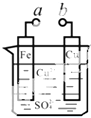 某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )
某化学兴趣小组为探究电化学原理,设计了如图装置(铁、铜为电极,烧杯中盛装硫酸铜溶液).下列叙述不正确的是( )| A. | a和b不连接时,铁片上会有金属铜析出 | |
| B. | a和b用导线连接时,铁片上发生的反应为:Fe-3e-=Fe3+ | |
| C. | 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 | |
| D. | a和b分别连接直流电源正、负极,Cu2+向铜电极移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫在空气中的燃烧产物是二氧化硫,在纯氧中的燃烧产物是三氧化硫 | |
| B. | 铜与浓硫酸反应产生二氧化硫,而锌与浓硫酸反应产生氢气 | |
| C. | 二氧化硅是酸性氧化物能和烧碱溶液反应 | |
| D. | 在常温下,浓硫酸不与铜反应,是因为铜被钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①→②→③→④ | B. | ①→③→②→④ | C. | ①→③→④→② | D. | ①→④→②→③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 节日燃放的烟花,就是碱金属以及锶、钡等金属化合物焰色反应所呈现的色彩 | |
| B. | 铝制饭盒不宜长时间存放酸性或碱性的食物 | |
| C. | 可以用ClO2、O2代替Cl2对自来水进行消毒 | |
| D. | 玛瑙饰物的主要成分与制造计算机芯片的主要成分相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HPO32-既能电离也能水解 | |
| B. | Na2HPO3溶液一定呈碱性 | |
| C. | H3PO3具有还原性 | |
| D. | H3PO3的溶液中加入过量NaOH,生成Na3PO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.
]2-,CO2的结构式为O=C=O.与镁同周期、离子半径最小的元素,其原子最外层的电子排布式为3s23p1,其中能量最高的电子有1个.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 +NaCl;
+NaCl;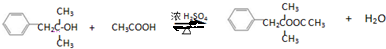 ;
;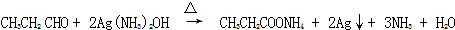 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com