
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的 pH 在 5.0~6.0 之间,通过电解生成 Fe(OH)3 沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成 浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。某科研小组用电浮选凝聚法处理污水,设计装置如图所示: (1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,则无法使悬浮物形成浮渣。
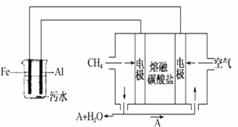
此时,应向污水中加入适量的_________。
a. H2SO4 b.BaSO4 c.Na2SO4 d.NaOH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①______________;
②4OH--4e-=2H2O+O2↑
(3)电极反应①和②的生成物反应得到 Fe(OH)3 沉淀的离子方程式是__________。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以 CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应是 CH4+4CO2-8e-===5CO2+2H2O。
①正极的电极反应是______________。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。 则 A 物质的化学式是___________。
(5)实验过程中,若在阴极产生了 44.8L(标准状况)气体,则熔融盐燃料电池消耗 CH4_____L(标准状况)。
【知识点】原电池、计算 A2 F3
【答案解析】(1)c
(2)Fe-2e-=Fe2+
(3)4Fe2++10H2O+O2=4Fe(OH)3↓+8H+
(4)①O2+2CO2+4e-=2CO32-(2O2+4CO2+8e-=4CO32-)②CO2
(5)11.2
解析:(1)为了增强溶液的导电性,因此可选用易溶性的强电解质溶液,排除be,考虑到题中要求电解时保持污水的pH在5.0~6.0之间,因此不能添加ad。
(2) 右边装置是燃料电池,而且通入甲烷的一极是负极,则电解时铝是阴极,铁作阳极,因此主要发生Fe-2e-=Fe2+,同时也发生副反应,即溶液中的OH-失电子被氧化生成O2。
(3) 电极反应①生成Fe2+和②的生成物O2反应得到 Fe(OH)3 沉淀,根据得失电子守恒和电荷守恒即可得离子方程式:4Fe2++10H2O+O2=4Fe(OH)3↓+8H+。
(4)①燃料电池的正极是氧气得到电子,然后与CO2结生成CO32-,同时根据碳守恒可知A必为CO2。②阴极产生H2,根据CH4~4H2知生成了 44.8L(标准状况)氢气,消耗CH411.2L.
【思路点拨】电池电极反应可用总反应减去其中一个电极的反应可得另外一个电极反应,如本题的总反应是CH4+2O2=CO2+2H2O减去已知负极的电极反应得正极反应;另外在书写电极反应时要注意电荷、质量、得失电子守恒。


科目:高中化学 来源: 题型:
由黄铜矿(主要成分是CuFeS2) 炼制精铜的工艺流程示意图如下:
炼制精铜的工艺流程示意图如下:
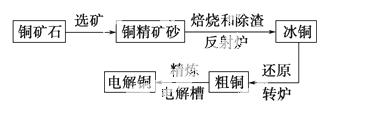
(1)在反射炉中,把铜精矿砂和石英砂混合加热到1 000 ℃左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物。该过程中两个主要反应的化学方程式分别是____________________、__________________________,反射炉内生成 炉渣的主要成分是________;
炉渣的主要成分是________;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1 200 ℃左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是____________;
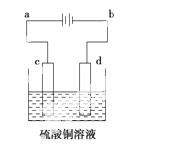
(3)粗铜的电解精炼如右图所示。在粗铜的电解过程中,粗铜板应是图中电极________(填图中的字母);在电极d上发生的电极反应式为____________________________;若粗铜中还含有Au、Ag、Fe,它们在电解槽中的存在形式和位置为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有X、Y、Z、W四种含14个电子的粒子,其结构特点如下:
| 粒子代码 | X | Y | Z | W |
| 原子核数 | 单核 | 不同元素构成的两核 | 同元素构成的两核 | 同元素构成的两核 |
| 粒子的电荷数 | 0 | 0 | 两个负电荷 | 0 |
(1)A原子核外比X原子多3个电子,A的原子结构示意图是____________,X的氧化物晶体中含有化学键类型是____________,含1 mol X的氧化物晶体中含有共价键数目为________。
(2)Z与钙离子组成的化合物的电子式为_________________,
其晶体类型为____________。
(3)14 g Y完全燃烧放出的热量是141.5 kJ,写出Y燃烧的热化学方程式______________________。
(4)组成W的元素最高价氧化物对应的水化物甲有下图所示转化关系(反应条件和其他物质已略)

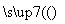

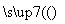

①写出丁在高温下与水蒸气反应的化学方程式________________________。
②组成W的元素的简单氢化物极易溶于水的主要原因是
______________________,该氢化物与空气可以构成一种燃料电池,电解质溶液是KOH溶液,其负极的电极反应式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知G、Q、X、Y、Z均为含氯元素的化合物,在一定条件下有下列转化关系(未配平):
①G—→Q+NaCl
②Q+H2O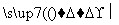 X+H2
X+H2
③Y+NaOH—→G+Q+H2O
④Z+NaOH—→Q+X+H2O
这五种化合物中Cl元素化合价由低到高的顺序是 ( )
A.G、Y、Q、Z、X B.X、Z、Q、G、Y
C.X、Z、Q、Y、G D.G、Q、Y、Z、X
查看答案和解析>>
科目:高中化学 来源: 题型:
足量的铜与一定量的浓硝酸反应得到硝酸铜溶液和NO、N2O4、NO2 的混合气体,这些气体与1.68升O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。则和铜反应的硝酸的物质的量可能是( )
A.0.4mol B.0.55mol C.0.6mol D.0.65mol
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏伽德罗常数的数值。下列说法正确的是
A.1mol甲苯含有6NA个C-H键
B.18gH2O含有10NA个质子
C.标准状况下,22.4L氨水含有NA个NH3分子
D.56g铁片投入足量浓硫酸中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列条件下,两瓶气体所含原子数一定相等的是 ( )
A.同质量的C2H4和CO B.同体积、同密度的C2 H4和C3 H6
C.同温度、同体积的H2和N2 D.同压强、同体积的N2 O和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
同温同压下,两个容积相等的储气瓶,一个装有C2H4,另一个装有C2H2和C2H6的混合气体,两瓶内气体一定具有 相同的 ( )
相同的 ( )
A.质量 B.原子总数 C.碳原子数 D.密度
查看答案和解析>>
科目:高中化学 来源: 题型:
图中,“——”表示相连的物质间在一定条件下可以反应,“—→”表示丁在一定条件下可以转化为乙。下面四组选项中,符合图示要求的是( )
| 甲 | 乙 | 丙 | 丁 | |
| A | H2SO4 | Na2SO4 | NaOH | NaCl |
| B | KCl | K2CO3 | KOH | HCl |
| C | O2 | CO | CuO | C |
| D | Fe | CuCl2 | Ag | HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com