
【题目】下列叙述中,正确的是( )
A.在多电子原子里,能量高的电子通常在离核近的区域内活动
B.核外电子总是优先排在能量低的电子层上
C.有两种微粒,若核外电子排布完全相同,则其化学性质一定相同
D.微粒的最外层只能是8个电子才稳定
科目:高中化学 来源: 题型:
【题目】根据问题填空:
(1)在S2﹣、Fe2+、Fe3+、Mg2+、S、I﹣、H+中,只有氧化性的是 , 只有还原性的是 , 既有氧化性又有还原性的是 .
(2)分析氧化还原反应2P+5Br2+8H2O=2H3PO4+10HBr,用“双线桥法”表示出反应中电子转移的方向和数目为 . 反应中氧化剂与还原剂的物质的量之比为 .
(3)氧化还原反应3S+6KOH=K2S+K2SO3+3H2O中,氧化产物是 , 还原产物是 . 该反应的离子方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值.下列说法不正确的是( )
A.常温常压下,2gD2O中含有的电子总数为NA
B.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.1mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA
D.室温下,1 L pH=13的NaOH溶液中,由水电离的OH﹣数目为10﹣13NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学按如图所示的装置进行电解实验.下列说法不正确的是( )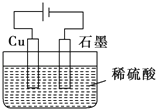
A.电解过程中,铜电极上有H2产生
B.电解初期,总反应方程式为 Cu+H2SO4 ![]() CuSO4+H2↑
CuSO4+H2↑
C.电解一定时间后,石墨电极上有铜析出
D.整个电解过程中,H+的浓度不断减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与我们的生活息息相关。下列描述正确的是( )
A.SO2具有漂白性,可用过量的SO2漂白薯片
B.Fe2O3俗称铁红,常作红色油漆和涂料
C.BaCO3可与胃酸反应,可作抗酸药物
D.明矾水解产生胶体,常用于水体消毒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为直流电源电解稀Na2SO4水溶液的装置.通电后在石墨电极a和b附近分别滴加一滴石蕊试液,下列实验现象中正确的是( )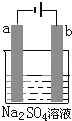
A.a电极附近呈蓝色,b电极附近出现红色
B.一电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近出现蓝色
D.逸出气体的体积a电极的小于b电极的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在基态多电子原子中,下列关于核外电子能量的叙述错误的是( )
A.最易失去的电子能量最高
B.电离能最小的电子能量最高
C.p轨道电子能量一定高于s轨道电子能量
D.在离核最近区域内运动的电子能量最低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用二氧化锰与浓盐酸反应制备氯气.二氧化锰与浓盐酸在加热的条件下生成氯化锰(MnCl2)、氯气和一种液态氧化物.
(1)写出该反应的化学方程式,并标出电子转移的方向和数目.
(2)若用含二氧化锰80%的软锰矿21.8g与80.0mL的浓盐酸反应,求:①浓盐酸的浓度,②标准状况下产生气体的体积.(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁铝合金用途很广泛,比如用作手机机身,我校课外活动小组欲对某一品牌手机机身的铝镁合金进行研究,测定其中铝的质量分数. I.他们利用盐酸、氢氧化钠溶液设计下列实验方案:
方案:铝镁合金 ![]() 溶液
溶液 ![]() 称量灼烧产物的质量.
称量灼烧产物的质量.
(1)镁铝合金的硬度比金属铝的硬度(选填:大、小).
(2)若实验中需要240mL0.6mol/L盐酸,配制时需要量取密度为1.2g/mL 质量分数为36.5%浓盐酸的体积为mL,所需的玻璃仪器有:烧杯、玻璃棒、量筒、 .
(3)用该方案进行实验时,除了称量灼烧产物的质量外,还需称量的是 .
(4)II.拓展研究:在向铝镁合金溶于盐酸后的溶液中加入过量NaOH溶液时,生成沉淀的质量与加入NaOH溶液体积的关系可用数轴关系表示: 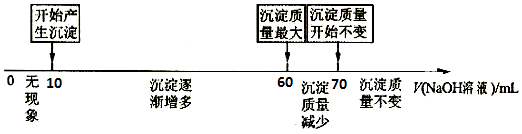
当加入60~70mL氢氧化钠溶液时,请写出发生的离子方程式 .
(5)请判断,根据上图数轴中的数据能否求出合金中铝的质量分数?(选填“能”或“不能”). 下列①②两题选一题作答.
①若不能求出合金中铝的质量分数,请说明理由 .
②若能求出合金中铝的质量分数,则铝的质量分数为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com