
 CH3OH��g��+H2O��g�� ��H="-49.0" kJ/mol
CH3OH��g��+H2O��g�� ��H="-49.0" kJ/mol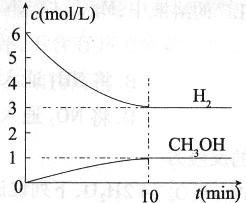
A��0��10 min��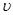 ��H2��="0.3" mol/��L��min�� ��H2��="0.3" mol/��L��min�� |
| B��T��ʱ��ƽ�ⳣ��K=1/27��CO2��H2��ת������� |
| C��T��ʱ����Ӧ�е���32 g CH3OH����ʱ���ų�49.0 kJ������ |
| D���ﵽƽ��������¶Ȼ��ٳ���CO2���壬���������H2��ת���� |
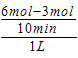 =0.3mol/��L��min������A��ȷ�� B��ƽ��ʱc��H2��=3mol��L��1��c��CO2��=1mol��L��1��c��CH3OH��=1mol��L��1��c��H2O��=1mol��L��1������ƽ�ⳣ��K=
=0.3mol/��L��min������A��ȷ�� B��ƽ��ʱc��H2��=3mol��L��1��c��CO2��=1mol��L��1��c��CH3OH��=1mol��L��1��c��H2O��=1mol��L��1������ƽ�ⳣ��K=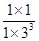 =
=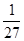 ��CO2��H2��ת���ʾ�Ϊ50%����B��ȷ��C����ͼ��֪��ƽ��ʱ����1molCH3OH���ų�����Ϊ49kJ��64gCH3OH�����ʵ���Ϊ
��CO2��H2��ת���ʾ�Ϊ50%����B��ȷ��C����ͼ��֪��ƽ��ʱ����1molCH3OH���ų�����Ϊ49kJ��64gCH3OH�����ʵ���Ϊ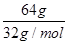 =2mol�����Էų�98.0kJ����������C��ȷ��D����H��0�������¶ȣ�ƽ�������ƶ���H2��ת���ʼ�С����ƽ����ٳ���CO2���壬ƽ�������ƶ����������H2��ת���ʣ���D����
=2mol�����Էų�98.0kJ����������C��ȷ��D����H��0�������¶ȣ�ƽ�������ƶ���H2��ת���ʼ�С����ƽ����ٳ���CO2���壬ƽ�������ƶ����������H2��ת���ʣ���D����


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
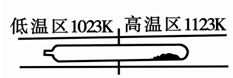
| A���ڲ�ͬ�¶�����TaI4 ������ͬ |
| B�����ᴿ�����У�S2 ������������ |
| C���÷�Ӧ��ƽ�ⳣ������TaI4 ��S2 ��Ũ����������� |
| D�����ᴿ�����У�I2 �������ǽ�TaS2 �Ӹ�����ת�Ƶ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OH(g) ��H=��92.9kJ/mo1
CH3OH(g) ��H=��92.9kJ/mo1| A���÷�Ӧ�ġ�S<0 |
| B���÷�Ӧ���κ��¶��¾����Է����� |
| C���������г�������He��ƽ��������Ӧ�����ƶ� |
| D�������¶�ƽ��������Ӧ�����ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3(g)+Q��Q>0����Ӱ������ͼ��ʾ������˵����ȷ����
2NH3(g)+Q��Q>0����Ӱ������ͼ��ʾ������˵����ȷ����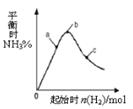
| A����Ӧ��b��ﵽƽ�� |
| B��b��H2��ת������� |
| C��c��N2��ת������� |
| D��a��b��c�����ƽ�ⳣ��Kb > Ka > Kc |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OH(g) ��H��0
CH3OH(g) ��H��0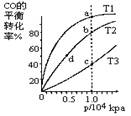
| A��ƽ�ⳣ����K(a)��K(c) K(b)��K(d) |
| B������Ӧ���ʣ�v(a)��v(c) v(b)��v(d) |
| C��ƽ��Ħ��������M(a)��M(c) M(b)��M(d) |
| D��ƽ��ʱa��һ����n(CO)��n(H2)��1:2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
| A���ϳɰ���Ӧ��ʹ�ô�����˵���������Դٽ���ƽ�������ɰ��ķ����ƶ� |
| B�������£���pH =10�İ�ˮϡ�ͣ���Һ����������Ũ�ȶ���С |
| C��100 mL pH��3��HA��HB�ֱ���������п��Ӧ,HA�ų���������,˵��HA���Ա�HB�� |
D����֪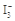  I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� I2��I������ʢ��KI3��Һ���Թ��м�������CCl4�����ú�CCl4������ɫ��˵��KI3��CCl4�е��ܽ�ȱ���ˮ�еĴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO (g)+H2O (g)���仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���| t / �� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)+qD(g) ��H<0�������������
pC(g)+qD(g) ��H<0�����н����д�������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI(g) ��H =" -14.9" kJ/mol���ڼס������������ͬ�ܱ������г��뷴Ӧ����ֺ��º��ݣ�����ʼŨ�����±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)="0.008" mol/L�� �����ж���ȷ��
2HI(g) ��H =" -14.9" kJ/mol���ڼס������������ͬ�ܱ������г��뷴Ӧ����ֺ��º��ݣ�����ʼŨ�����±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)="0.008" mol/L�� �����ж���ȷ��| ��ʼŨ�� | c(H2) / mol/L | c(I2) / mol/L | c(HI) / mol/L |
| �� | 0.01 | 0.01 | 0 |
| �� | 0.02 | 0.02 | 0 |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com