
| A. | 用水鉴别乙醇和苯 | |
| B. | 用碳酸氢钠溶液鉴别乙酸和乙醇 | |
| C. | 用新制的氢氧化铜悬浊液鉴别葡萄糖和蔗糖 | |
| D. | 用溴的四氯化碳溶液鉴别裂解气和焦炉气 |
分析 A.乙醇易溶于水,而苯与水互不相溶;
B.乙酸与碳酸氢钠反应生成二氧化碳气体;
C.葡萄糖为还原性糖;
D.裂解气和焦炉气都含有不饱和烃.
解答 解:A.乙醇易溶于水,而苯与水互不相溶,溶液分层,可鉴别,故A不选;
B.乙酸的酸性比碳酸强,可与碳酸氢钠反应生成二氧化碳气体,乙醇不反应,可鉴别,故B不选;
C.葡萄糖为还原性糖,可与氢氧化铜浊液发生氧化还原反应,而蔗糖不反应,不能鉴别,故C不选;
D.裂解气和焦炉气都含有不饱和烃,应溴的四氯化碳溶液不能鉴别,故D选.
故选D.
点评 本题考查物质的鉴别,为高频考点和常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质的异同,为解答该类题目的关键,难度不大.


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 由${\;}_{1}^{2}$H和${\;}_{8}^{18}$O所组成的11g水中所含中子数为6NA | |
| B. | H2O和D2O互称为同素异形体,且两者的化学性质相似 | |
| C. | ${\;}_{8}^{18}$O2和${\;}_{8}^{16}$O3互称为同位素 | |
| D. | 金刚石和石墨互为同素异形体,两者之间的转化属于物理变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
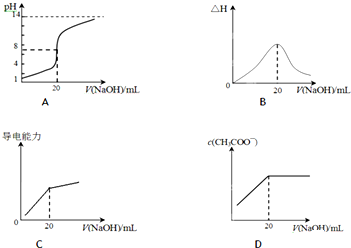 Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.
Ⅰ.常温下,某水溶液中只存在下列四种离子:Na+、A-、H+、OH-,据题意回答下列问题.| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1=4.2×10-7 | HClO | 3×10-8 |
| Ka2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;
;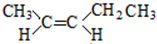 、
、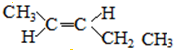 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
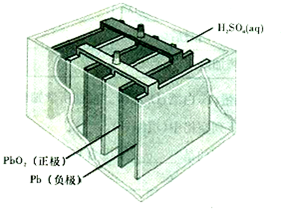
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
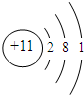 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③④ | B. | ①③⑤ | C. | ①②⑤ | D. | ①④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)
如图所示的直型石英玻璃封管中充有CO气体,左端放置不纯的镍(Ni)粉.在一定条件下,Ni可以与CO(g)发生如下反应:Ni(s)+4CO(g)$?_{453~473K}^{323~353K}$Ni(CO)4(g)| A. | 在石英管右端主要物质是Ni(CO)4(g) | |
| B. | 在石英管右端主要物质是纯Ni(s)和CO(g) | |
| C. | 在石英管左端主要物质是纯Ni(s)和CO(g) | |
| D. | 整个过程可以看作CO(g)将Ni(s)从石英管左端转移到右端,从而达到提纯目的 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com