
【题目】下列反应属于吸热反应的是( )
A.甲烷在空气中燃烧
B.葡萄糖在人体内氧化分解
C.Ba(OH)2·8H2O与NH4Cl反应
D.锌粒与稀H2SO4反应制取H2
科目:高中化学 来源: 题型:
【题目】FeCO3与砂搪混用可以作补血剂,实验室里制备FeCO3的流程如图所示。

下列说法错误的是
A. 降低温度防止NH4HCO3和FeSO4分解
B. 沉淀过程中有CO2气体放出
C. 过滤操作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D. 产品FeCO3在空气中高温分解可得到纯净的FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流电池,简称钒电池,它的电能是以化学能的方式存储在不同价态钒离子的硫酸电解液中,采用质子交换膜作为电池组的隔膜,电解质溶液平行流过电极表面并发生电化学反应。电池总反应为VO2++V3++H2O![]() V2++VO2++2H+。下图是钒电池基本工作原理示意图。下列说法错误的是
V2++VO2++2H+。下图是钒电池基本工作原理示意图。下列说法错误的是

A. 电池完全放电后,正、负极分别为VO2+和V3+离子溶液
B. 放电时,负极反应式为V2+-e-=V3+
C. 充电过程中,负极电解液的pH不变
D. 充电时,阳极反应式为VO2++H2O-e-=VO2++2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钠在供氧、防腐、除臭、微量分析等多方面有着重要用途,工业生产过氧化钠的方法是将除去二氧化碳且干燥后的空气通入熔融的钠(温度180~200℃)中得到氧化钠,然后增加空气流量并迅速升高温度至300~400℃即可得到过氧化钠。某化学兴趣小组模拟工业流程制备过氧化钠的装置如图所示。

请回答下列相关问题。
(1)浓硫酸的作用是______________。
(2)升温至300~400℃时发生主要反应的化学方程式是______________。
(3)下列选项中的加热方式适合该实验的是_____(填字母)。
A.水浴 B.油裕(100~260℃) C.控温电炉(150~500℃) D.酒精喷灯(1000~1200℃)
(4)若要提高产品纯度,需在具支试管后添加一个装置,该装置应该是________。
(5)在具支试管后添加(4)中所要求的装置后,某同学还认为制得的过氧化钠中还含有少量的某种杂质,该杂质是________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 不溶于水和稀硫酸,制取流程如下:

请回答下列问题:
(1)溶液X是_______。
(2)在黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 中,x、y、z的代数关系式为_______。
(3)检验滤液中是否存 在K+的操作是_______。
(4)黄钾铵铁矾的化学式可通过下列实验测定:
步骤1: 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶配制成100.00mL 溶液A。
步骤2: 最取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g。
步骤3: 量取25.00mL溶液A,加入足最NaOH溶液,加热,收集到标准状下气体224mL,同时有红褐色沉淀生成。
步骤4: 将步骤3所得沉淀过滤、洗涤、灼烧,最终得固体4.80g。
①步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需_______。
②根据以上实验数据计算黄钾铵铁矾中的n(OH-)∶n(SO42-)的比值为_______。(写出必要的计算过程,否则不得分)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示500℃时,X、Y、Z三种气体在容积固定的容器中反应,各物质的浓度随时间的变化情况.达到平衡后,改变压强,平衡不移动.下列说法中正确的是( ) 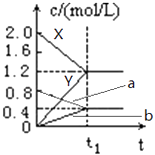
A.Z物质的变化情况为曲线b
B.该反应的化学方程式为:2X(g)3Y(g)+Z(g)
C.0→t1 , X的物质的量浓度变化量为1.2mol/L
D.若t1=1min,则v(Y )=0.02molL﹣1s﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中因含有机物而具有较高的化学耗氧量.常用酸性KMnO4氧化有机物测其含量.主要操作步骤如下: 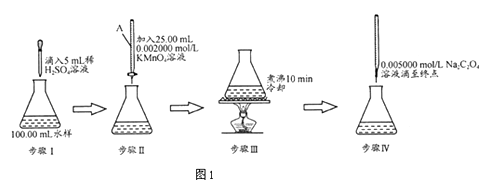
(1)仪器A为(填酸式或碱式)滴定管;要顺利完成实验,步骤Ⅲ中溶液颜色应为;
(2)完善步骤Ⅳ涉及的离子方程式:
C2O42﹣+MnO4﹣+H+═Mn2++CO2↑+;
该步骤中滴入第一滴Na2C2O4时褪色较慢,以后的滴定中褪色较快,其原因是
(3)若步骤Ⅳ中所用Na2C2O4溶液为20.00mL,已知滴定后的液面如图所示,请在图2中标出滴定前的液面. 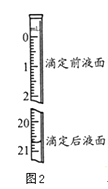
(4)若实验测量结果比实际有机物含量偏高,分别从以下两个方面猜想:
猜想1:水样中Cl﹣影响
猜想2:配制Na2C2O4标液定容时;
(5)若猜想1成立,请根据资料卡片补充完善上述实验以消除Cl﹣影响.(限选试剂:AgNO3溶液、Ag2SO4溶液、KMnO4溶液、Na2C2O4溶液) .
资料卡片:
①有机质可HNO3被氧化
②AgCl不与酸性KMnO4溶液反应
③Ag2C2O4可被酸性KMnO4溶液氧化.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH2OH(羟胺)是一种无色针状结晶,羟胺及其盐类常用作有机合成的还原剂。回答下列问题:
(1) NH2OH的电子式为________________。
(2)拉西法制备羟胺的总反应为2NO2-+4SO2+6H2O+6NH3=4SO42-+6NH4++2NH2OH。该反应中NH3__________(填“作氧化剂”“作还原剂”或“既不作氧化剂又不作还原剂”)。
(3)室温时,NH2OH会发生分解反应,分解产生的无色气体遇浓盐酸产生白烟,与空气接触变为红棕色;且其分解产物会使无水CuSO4变蓝色,则NH2OH分解反应的化学方程式为______________________。
(4)催化还原NO是制备盐酸羟胺的一种方法,其反应原理如下:2NO+3H2+2HCl![]() 2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:
2NH2OH·HCl,某校合作学习小组的同学设计了如图所示装置制备盐酸羟胺:

①该实验适宜的加热方式为______________。
②装置中导管X的作用是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com